Как добывают аргон
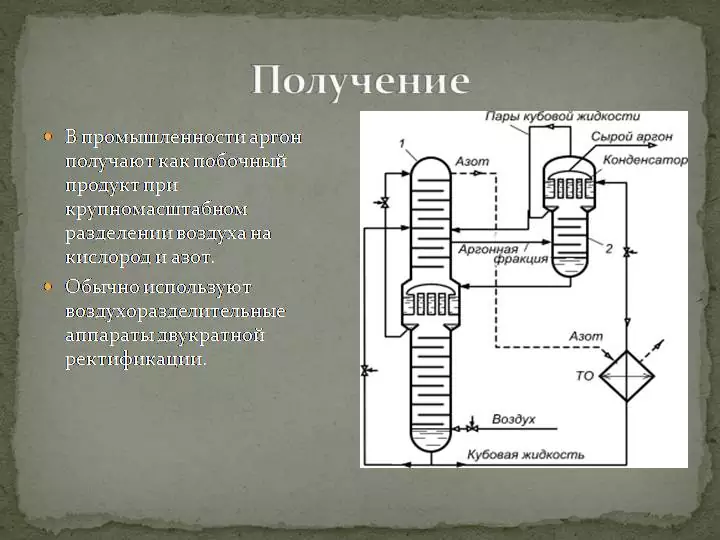
Ar не поддается изменениям в процессе его использования и всегда возвращается в атмосферу. Поэтому ученые считают данный источник неисчерпаемым. Он добывается как сопутствующий продукт при разделении воздуха на кислород и азот посредством низкотемпературной ректификации.
Для реализации этого метода применяются специальные воздухоразделительные аппараты, состоящие из колонн высокого, низкого давления и конденсатора-испарителя. В результате процесса ректификации (разделения) получается аргон с небольшими примесями (3-10%) азота и кислорода. Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.

Представлены установки по производству данного химического элемента.
Хранится и транспортируется газ аргон в стальных баллонах (ГОСТ 949-73), которые имеют серый окрас с полосой и соответствующей надписью зеленого цвета. При этом процесс наполнения емкости должен полностью соответствовать технологическим нормам и правилам безопасности. Детальную информацию о специфике заполнения газовых баллонов можно прочитать в статье: баллоны со сварочной смесью – технические особенности и правила эксплуатации.
История открытия
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею своё сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном.


Распространение в природе
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе.
Аргон (вместе с неоном) наблюдается на некоторых звёздах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,288 % по массе, его запасы в атмосфере оцениваются в 4·1014 т.

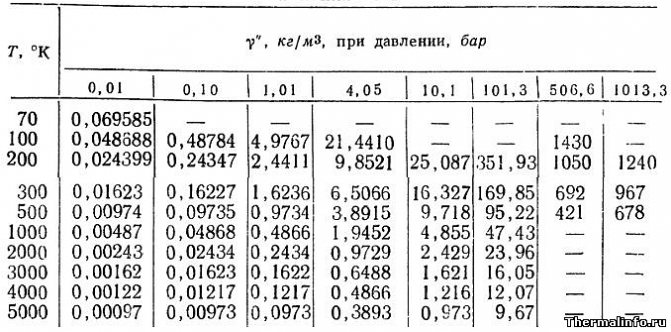
Плотность аргона при различных температурах и давлениях
В таблице указаны значения плотности аргона в газообразном состоянии при различных температурах и давлениях. Плотность аргона в таблице указана при температуре от -203 до 4727 °С и давлении от 0,01 до 1013 атмосфер.
По данным таблицы при давлении 507 атмосфер и температуре -173 °С газообразный аргон имеет максимальную плотность 1430 кг/м3. Минимум плотности аргона достигается при разряжении 0,01 атм. и температуре 4727 °С (плотность составляет 0,00097 кг/м3).

Свойства аргона (таблица): температура, плотность, давление и пр.
| Название | Аргон |
| Латинское название | Argon |
| Английское название | Argon |
| Символ | Ar |
| Атомный номер (номер в таблице) | 18 |
| Тип | Неметалл |
| Группа | Инертный (благородный) газ |
| Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| Год открытия | 1894 г. |
| Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| Происхождение | Природный материал |
| Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| Содержание в земной коре (по массе) | 0,00015 % |
| Содержание в морях и океанах (по массе) | 0,000045 % |
| Содержание во Вселенной и космосе (по массе) | 0,02 % |
| Содержание в Солнце (по массе) | 0,007 % |
| Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) |
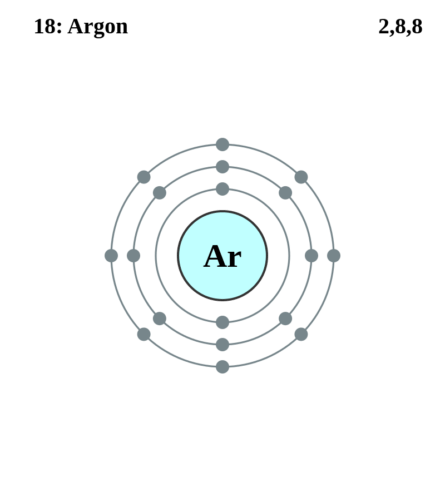
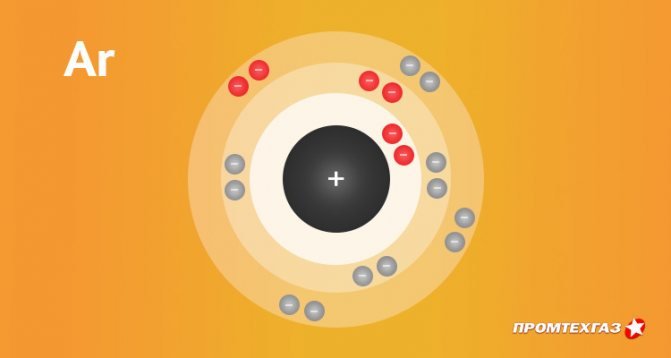
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0
|
| Радиус атома (вычисленный) | 71 пм |
| Ковалентный радиус* | 106 пм |
| Радиус Ван-дер-Ваальса | 188 пм |
| Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| Семейство (блок) | элемент p-семейства |
| Период в периодической таблице | 3 |
| Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| Степени окисления | 0 |
| Валентность | 0 |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| Электродный потенциал | 0 |
| Энергия сродства атома к электрону | 0 кДж/моль |
| Плотность* | 0,001784 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,3954 г/см3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость),1,65 г/см3 (при -233 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| Температура плавления* | -189,34 °C (83,81 K, -308,81 °F) |
| Температура кипения* | -185,848 °C (87,302 K, -302,526 °F) |
| Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,18 кДж/моль |
| Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,53 кДж/моль |
| Молярная теплоёмкость* | 20,85 Дж/(K·моль) |
| Молярный объём | 24,2 см³/моль |
| Теплопроводность | 17,72·10-3 Вт/(м·К) (при стандартных условиях), 0,0164 Вт/(м·К) (при 300 K) |
| Структура решётки | Кубическая гранецентрированная
|
| Параметры решётки | 5,260 Å |
| Температура Дебая | 85 К |
| Название пространственной группы симметрии | Fm_ 3m |
| Номер пространственной группы симметрии | 225 |
| Номер CAS | 7440-37-1 |
Примечание:
206* Ковалентный радиус аргона согласно [1] составляет 106±10 пм.
401* Плотность аргона согласно [3] и [4] [Россия] составляет 0,0017839 г/см3 (при 0 °C /20 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления аргона согласно [3] и [4] составляет -189,35 °C (83,8 K, -308,83 °F) и -189,6 °C (83,55 K, -309,28 °F) соответственно.
403* Температура кипения аргона согласно [3] и [4] составляет -185,85 °C (87,3 K, -302,53 °F) и -185,9 °C (87,25 K, -302,62 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) аргона согласно [3] и [4] составляет 7,05 кДж/моль и 1,19 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) аргона согласно [3] и [4] составляет 6,45 кДж/моль и 6,51 кДж/моль соответственно.
410* Молярная теплоемкость аргона [3] составляет 20,79 Дж/(K·моль).
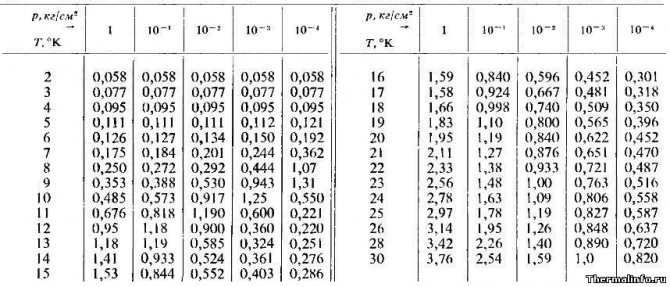
Теплопроводность аргона при низких температурах и давлениях
В таблице представлены значения теплопроводности аргона в ионизированном состоянии при сверхнизкой температуре и давлении (разряжении) Теплопроводность в таблице дана в размерности ккал/(м·час·град)
при температуре от 2 до 30 К и разряжении до 0,0004 атмосферы.
По данным таблицы видно, что максимальная теплопроводность ионизированного аргона равна 3,76 ккал/(м·час·град).

Источники: 1. Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. 2. Чиркин В.С. Теплофизические свойства материалов ядерной техники.
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина, например, Ar·6H2O.


Классификация аргона по сортам
Аргон обеспечивает хорошую защиту сварочной ванны. В зависимости от назначения и содержания этот газ делится на три сорта. Высший сорт аргона (99,99% Ar) используется для сварки, химически активных металлов, циркония, титановых сплавов, молибдена, сплавов на их основе, ответственных конструкций из нержавеющих сталей. Первый сорт аргона (99,98% Ar) применяется для сварки неплавящимся электродом, магния, алюминия, магниевых и алюминиевых сплавов, менее чувствительных к примесям кислорода и азота. Второй сорт аргона (99,95% Ar) используется для сварки нержавеющих сталей, жаропрочных сплавов и чистого алюминия. Для сварки могут также использоваться смеси аргона с другими газами (кислородом, углекислым газом).
Применение аргона
Наиболее часто аргон применяют:
- как защитный газ при сварке;
- как плёнкообразующий газ при плазменной сварке и резке;
- для вытеснения кислорода и влаги из упаковки при хранении пищевых продуктов, что увеличивает срок их хранения (пищевая добавка Е938);
- как газ для тушения огня в некоторых системах пожаротушения.
Применение аргона в сварке
Аргон применяют в качестве защитной среды при сварке активных и редких металлов (титана, циркония и ниобия) и сплавов на их основе, алюминиевых и магниевых сплавов, а также хромоникелевых коррозионностойких жаропрочных сплавов, легированных сталей различных марок.


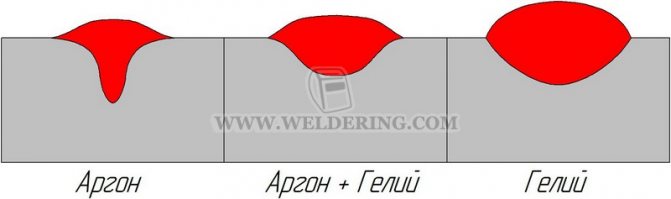
Для сварки черных металлов аргон обычно используются в смеси с другими газами — кислородом, гелием, двуокисью углерода или водородом.
Аргон, являясь более тяжелым, чем воздух, своей струей лучше защищает металл при сварке в нижнем положении. Растекаясь по поверхности свариваемого изделия, он защищает достаточно длительно довольно широкую и протяженную зону как расплавленного, так и нагретого при сварке металла.
Низкий ионизационный потенциал аргона помогает получить превосходный профиль сварочного шва и сохранять хорошую и устойчивую дугу от начала до конца. В тоже время, низкий потенциал ионизации является причиной и низкого напряжения на дуге, что снижает тепловую мощность дуги. Для более подробной информации рекомендуем статью о свойствах сварочной дуги в инертных газах — аргоне и гелии.
Применение аргона позволяет повысить температуру сварочной дуги, что улучшает проплавление сварного шва, увеличивая производительность сварки в целом. При этом проплавление приобретает «кинжальную» форму, что дает возможность выполнять однопроходную сварку в щелевую разделку металла больших толщин. При сварке в среде аргона (как и иных инертных газов) минимизируется выгорание активных легирующих элементов, что позволяет использовать более дешевые сварочные проволоки.

При TIG сварке аргон служит защитой не только для сварочной ванны от вредного воздействия воздуха, а также инертной защитой конца электрода.
Для дуговой сварки в целом аргон применяется гораздо чаще, чем гелий, однако при сварке листового алюминия толщиной менее 6 мм аргон рекомендуют смешивать с гелием, чтобы обеспечить нужную теплопроводность. В некоторых случаях аргонно-гелиевые смеси используют для зажигания дуги, после чего сварка происходит в присутствии гелия. Этот метод применяется для сварки толстолистового алюминия вольфрамовым электродом при постоянном токе.
Изотопы
Аргон представлен в земной атмосфере тремя стабильными изотопами: 36Ar (0,337 %), 38Ar (0,063 %), 40Ar (99,600 %). Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии. Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах. Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона.
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl.
Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Производство аргона
Технический газ аргон получают в качестве побочного продукта производственного процесса, в ходе которого кислород отделяют от азота. Для этого применяются специальные камеры с использованием воздухоразделительных аппаратов с двукратной ректификацией. Аргон обладает большими летучими свойствами, чем кислород, и меньшими, чем азот. Поэтому в процессе разделения воздуха на кислород и азот аргон остается в средней фракции. Из средней точки верхней колонны аппарата аргон направляют в специальные камеры для сжатия и хранения.
При первичном отборе массовая доля аргона в отобранной фракции составляет ничтожно малые показатели, всего около пяти процентов. Это так называемый сырой аргон. После последующей конденсации и очистки удается получить чистый аргон с массовой долей содержания его во фракции около 99,99 процентов. Практикуется так же способ извлечения аргона в процессе утилизации отходов аммиачного производства. В этом случае аргон получают из азота, оставшегося после связывания его с молекулами водорода.
Аргон
Аргон
(лат. Argon), Ar, химический элемент VIII группы периодической системы Менделеева, относится к инертным газам; атомный номер 18, атомная масса 39,948. При обычных условиях Аргон — газ без цвета, запаха и вкуса. К открытию Аргона привело обнаруженное в 1892 году Дж. Рэлеем превышение на 0,0016 г/л (при 0°С и 101325 н/м2) плотности азота из воздуха по сравнению с плотностью азота, полученного из его соединений. В 1894 Рэлей и У. Рамзай выделили из азота воздуха газ, обладающий химические инертностью (греч. argos — бездеятельный). После открытия других инертных газов они были объединены в отдельную нулевую группу периодической системы; теперь общепринято рассматривать их как главную подгруппу VIII группы.
В природе Аргон присутствует только в свободном виде. Атмосфера содержит 16·1012т Аргон, земная кора 0,165·1012т, вода 0,752·1012 т. Объемная концентрация Аргон в воздухе 0,93%. Атмосферный Аргон состоит из трех стабильных изотопов: 36Аr (0,337%),38Аr (0,063%) и 40Аr (99,600%). Преобладание тяжелого изотопа связано с его образованием при радиоактивном распаде природного калия 40К (в результате общее количество Аргона в атмосфере непрерывно возрастает). Вследствие высокого содержания 40Аr атомная масса Аr больше, чем у следующего за ним в таблице Менделеева Калия. Из искусственно полученных радиоактивных изотопов Аргон для радиоактивной метки наиболее пригоден 37Аr с периодом полураспада 35,0 дней. Плотность Аргона (при 0°С и 101325н/м2) 1,7839 кг/м3, tпл — 189,2°С, tкип -185,8°С. В 1 л воды при нормальных условиях растворяется 51,9 см3 Аргона. В металлах Аргон практически не растворим. Молекула Аргона одноатомна. Энергия первичной ионизации Аргона (Аr0 → Аr+) велика (15,755 эв или 2,5241·10-18 Дж), сродством к электрону Аргон не обладает. Все попытки получить валентные соединения Аргона оканчивались неудачей. Аргон способен образовывать соединения включения (клатраты) с веществами, имеющими в своих кристаллических решетках полости с размерами, приблизительно соответствующими диаметру атома Аргона (Н2О, D2O, фенол, гидрохинон). Наиболее полно изучен Аr·6Н2О, впервые синтезированный в 1896 году П. Вийаром при кристаллизации воды в атмосфере Аргона (давление Аргона 15,5 Мн/м2). температура разложения Аr·6Н2О при 101325 Па 42,0°С. Аргон с фенолом дает соединение Аr·ЗС6H5ОН. В соединениях включения, например в SO2·6H2O, можно SO2 изоморфно заместить Аr (работы Б. А. Никитина и других), что дает возможность синтезировать Аr·6Н2О при нормальном давлении.
В промышленности Аргон получают в процессе разделения воздуха при глубоком охлаждении. Возможно получение Аргона из продувочных газов колонн синтеза аммиака. Отделять Аргон от других инертных газов лучше всего газохроматографическими методами. Аргон широко используется при термической обработке легко окисляющихся металлов. В защитной атмосфере из Аргона проводят, например, сварку и резку различных редких и цветных металлов, плавку Ti, W, Zr и т. д. В атмосфере Аргона выращивают кристаллы полупроводниковых материалов. Аргоном заполняют электрические лампочки (Аргон снижает скорость испарения вольфрама и позволяет увеличить светоотдачу). Аргоновые трубки применяют для рекламы (сине-голубое свечение). На определении отношения 40Аr:40К основан один из методов определения возраста минералов. Радиоактивный Аргон иногда применяют для контроля вентиляционных систем.
Доставка аргона и хранение
Транспортировка и хранение аргона допускается только в специализированных емкостях, газовых баллонах. В большинстве случаев для этого применяются сорокалитровые газовые баллоны. Баллоны с аргоном окрашиваются в серый цвет. Поперек баллона наносится зеленая полоса и надпись аналогичного цвета. Стандартное давление в баллонах с аргоном составляет сто пятьдесят атмосфер. В ряде случаев для снижения затрат на перевозку, аргон транспортируется в сжиженном состоянии. При этом его закачивают в специализированные ёмкости и сосуды Дюара. Также можно использовать и специализированные цистерны. Аргон не является взрывоопасным веществом. Меры предосторожности при его транспортировке в основном сводятся к тому, чтобы обеспечить сохранность самого технического газа, так как он обладает большой летучестью.
Теплопроводность аргона в газообразном состоянии при высоких температурах
В таблице приведены значения теплопроводности аргона в газообразном состоянии при нормальном атмосферном давлении при высоких температурах. Теплопроводность в таблице дана при температуре от 1500 до 5000 К (от 1227 до 4727 °С).
Из таблицы видно, что теплопроводность аргона при высоких температурах с ростом температуры также увеличивается и равна при 5000 К значению 0,131 Вт/(м·град). Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!
Аргон в сварочном процессе
В сварочных процессах аргон применяется при сварке ответственных узлов и агрегатов, которые нуждаются в повышенной защите от коррозийных процессов. Есть также такие сплавы и металлы, которые без применения аргона не могут быть обработаны при помощи сварочных операций. В частности, такие металлы, как тантал, ниобий, цирконий, гафний, вольфрам, уран, торий, титан, не могут подвергаться обработке без дополнительной защиты их при помощи инертного газа аргона.
При сварке в аргоне не применяются различные флюсы и электродные покрытия. Сварочные швы после такой обработки получаются совершенно чистыми и ровными. Они не нуждаются в дополнительной обработке в виде зачистки от остатков сварочного материала и шлаков. В ходе работ струя аргона полностью удаляет не только воздух из места сварки, но и все остаточные продукты.
Применение
Применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметаллов
- в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа.. Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
Периодическая система элементов
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
Химические семейства элементов периодической таблицы
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Страница 3: ГОСТ 10157-79. Аргон газообразный и жидкий. Технические условия (41816)
1,662 — плотность газообразного аргона при нормальных условиях, кг/м3;
1,392 — плотность жидкого аргона при нормальном давлении, кг/дм3.
Коэффициент (К) для вычисления объема газа в баллоне в м3 при нормальных условиях 20 ??С и 101,3 кПА (. рт. ст.)
| Температура газа в баллоне, °С | Избыточное давление газа в баллоне, МПа (кгс/см2) | |||||||||||
| 9,8 | 11,8 | 13,7 | 14,2 | 14,7 | 15,2 | 15,7 | 16,2 | 16,7 | 17,7 | 19,6 | 21,6 | |
| (100) | (120) | (140) | (145) | (150) | (155) | (160) | (165) | (170) | (180) | (200) | (220) | |
| -50 | 0,157 | 0,193 | 0,231 | 0,240 | 0,249 | 0,258 | 0,267 | 0,276 | 0,284 | 0,300 | 0,331 | 0,363 |
| -40 | 0,145 | 0,178 | 0,211 | 0,219 | 0,227 | 0,236 | 0,243 | 0,251 | 0,259 | 0,274 | 0,303 | 0,333 |
| -35 | 0,140 | 0,171 | 0,203 | 0,211 | 0,218 | 0,226 | 0,234 | 0,241 | 0,248 | 0,263 | 0,291 | 0,319 |
| -30 | 0,135 | 0,165 | 0,195 | 0,203 | 0,210 | 0,217 | 0,224 | 0,232 | 0,239 | 0,253 | 0,280 | 0,307 |
| -25 | 0,131 | 0,159 | 0,188 | 0,195 | 0,202 | 0,209 | 0,216 | 0,223 | 0,230 | 0,243 | 0,269 | 0,296 |
| -20 | 0,127 | 0,154 | 0,181 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,235 | 0,259 | 0,285 |
| -15 | 0,123 | 0,149 | 0,175 | 0,182 | 0,189 | 0,195 | 0,202 | 0,208 | 0,215 | 0,227 | 0,252 | 0,276 |
| -10 | 0,120 | 0,145 | 0,170 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,220 | 0,243 | 0,267 |
| -5 | 0,116 | 0,141 | 0,165 | 0,171 | 0,178 | 0,184 | 0,190 | 0,196 | 0,202 | 0,213 | 0,236 | 0,260 |
| 0 | 0,113 | 0,137 | 0,161 | 0,167 | 0,173 | 0,178 | 0,184 | 0,190 | 0,196 | 0,207 | 0,229 | 0,252 |
| +5 | 0,110 | 0,134 | 0,157 | 0,162 | 0,168 | 0,174 | 0,179 | 0,185 | 0,190 | 0,201 | 0,223 | 0,245 |
| +10 | 0,108 | 0,132 | 0,153 | 0,158 | 0,164 | 0,169 | 0,175 | 0,180 | 0,185 | 0,196 | 0,217 | 0,238 |
| +15 | 0,105 | 0,128 | 0,149 | 0,154 | 0,159 | 0,165 | 0,170 | 0,175 | 0,181 | 0,191 | 0,212 | 0,232 |
| +20 | 0,103 | 0,124 | 0,145 | 0,150 | 0,155 | 0,161 | 0,166 | 0,171 | 0,176 | 0,186 | 0,206 | 0,227 |
| +25 | 0,101 | 0,121 | 0,142 | 0,147 | 0,152 | 0,157 | 0,162 | 0,167 | 0,172 | 0,182 | 0,201 | 0,221 |
| +30 | 0,099 | 0,119 | 0,139 | 0,144 | 0,149 | 0,154 | 0,158 | 0,163 | 0,168 | 0,178 | 0,196 | 0,216 |
| +35 | 0,097 | 0,116 | 0,136 | 0,140 | 0,145 | 0,150 | 0,155 | 0,160 | 0,164 | 0,174 | 0,192 | 0,211 |
| +40 | 0,095 | 0,114 | 0,133 | 0,137 | 0,142 | 0,147 | 0,152 | 0,156 | 0,161 | 0,170 | 0,188 | 0,206 |
| +50 | 0,091 | 0,109 | 0,128 | 0,132 | 0,137 | 0,141 | 0,146 | 0,150 | 0,154 | 0,163 | 0,180 | 0,198 |
ПРИЛОЖЕНИЕ 2
Справочное
Значение коэффициента К2 для приведения объема газа к нормальным условиям
| Температура, ??С | Показания барометра, кПа (мм рт. ст.) | |||||||
| 93,3 | 94,6 | 96,0 | 97,2 | 98,6 | 100,0 | 101.3 | 102,6 | |
| (700) | (710) | (720) | (730) | (740) | (750) | (760) | (770) | |
| К2 | ||||||||
| 10 | 0,953 | 0,967 | 0,980 | 0,993 | 1,007 | 1,021 | 1,035 | 1,049 |
| 12 | 0,946 | 0,960 | 0,974 | 0,985 | 1,000 | 1,014 | 1,028 | 1,042 |
| 14 | 0,940 | 0,954 | 0,967 | 0,979 | 0,993 | 1,007 | 1,021 | 1,035 |
| 16 | 0,934 | 0,947 | 0,960 | 0,972 | 0,986 | 1,000 | 1,014 | 1,028 |
| 18 | 0,927 | 0,940 | 0,954 | 0,966 | 0,979 | 0,993 | 1,007 | 1,021 |
| 20 | 0,921 | 0,934 | 0,947 | 0,959 | 0,973 | 0,987 | 1,000 | 1,014 |
| 22 | 0,915 | 0,928 | 0,941 | 0,952 | 0,966 | 0,980 | 0,993 | 1,007 |
| 24 | 0,908 | 0,921 | 0,934 | 0,946 | 0,960 | 0,973 | 0,986 | 1,000 |
| 26 | 0,903 | 0,915 | 0,928 | 0,940 | 0,953 | 0,966 | 0,979 | 0,993 |
| 28 | 0,896 | 0,909 | 0,922 | 0,933 | 0,947 | 0,960 | 0,973 | 0,987 |
| 30 | 0,890 | 0,903 | 0,916 | 0,927 | 0,941 | 0,954 | 0,967 | 0,980 |
| 32 | 0,885 | 0,897 | 0,910 | 0,921 | 0,934 | 0,947 | 0,961 | 0,974 |
| 34 | 0,879 | 0,891 | 0,904 | 0,915 | 0,928 | 0,941 | 0,954 | 0,967 |
| 35 | 0,876 | 0,889 | 0,901 | 0,912 | 0,925 | 0,938 | 0,951 | 0,964 |
ПРИЛОЖЕНИЕ 2.(Измененная редакция, Изм. № 1).
ПРИЛОЖЕНИЕ 3. (Исключено, Изм. № 2).
ПРИЛОЖЕНИЕ 4
Обязательное
ОПРЕДЕЛЕНИЕ ОБЪЕМНОЙ ДОЛИ ВОДЯНЫХ ПАРОВ КОНДЕНСАЦИОННЫМ МЕТОДОМ
Объемную долю водяных паров определяют приборами конденсационного типа с пороговой чувствительностью не выше 1,5 млн-1 (pmm).
Относительная погрешность прибора не должна превышать 10 %.
Метод основан на измерении температуры насыщения газа водяными парами при появлении росы на охлажденной зеркальной поверхности.
Анализ проводят по инструкции, приложенной к прибору.
Объемную долю водяных паров в соответствии с найденной температурой насыщения определяют по табл. 1.
Таблица 1
| Объемная доля водяных паров, млн-1 (ppm) | Температура насыщения, oС | Объемная доля водяных паров, млн-1 (ppm) | Температура насыщения, oС |
| 2,55 | -70 | 23,4 | -54 |
| 3,44 | -68 | 31,1 | -52 |
| 4,60 | -66 | 39,4 | -50 |
| 6,10 | -64 | 49,7 | -48 |
| 8,07 | -62 | 63,2 | -46 |
| 10,6 | -60 | 80 | -44 |
| 14,0 | -58 | 101 | -42 |
| 18,3 | -56 | 127 | -40 |
Примечание. Объемная доля, равная 1 млн-1, соответствует 1 ?? 10-4 %.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, относительное расхождение между которыми не превышает допускаемое расхождение, равное 10 %.
Допускаемая относительная суммарная погрешность результата анализа ±25 % при доверительной вероятности Р = 0,95.
ПРИЛОЖЕНИЕ 4. (Измененная редакция, Изм. № 3).
ПРИЛОЖЕНИЕ 5
Рекомендуемое
ОПРЕДЕЛЕНИЕ ОБЪЕМНОЙ ДОЛИ СУММЫ УГЛЕРОДСОДЕРЖАЩИХ СОЕДИНЕНИЙ ГАЗОХРОМАТОГРАФИЧЕСКИМИ МЕТОДАМИ
А. Определение объемной доли двуокиси углерода, получаемой при окислении углеродсодержащих соединений окисью меди (по п. 4.6.2 настоящего стандарта).
1. Аппаратура, материалы и реактивы
Хроматограф с детектором по теплопроводности с порогом чувствительности по пропану при газе-носителе гелии не выше 2 ?? 10-5 мг/см3 и газохроматографической колонкой длиной , внутренним диаметром , наполненной активным углем.
Концентратор — U-образный. Для изготовления берется трубка из нержавеющей стали 6 ?? , длиной . Концентратор наполняется измельченным лабораторным стеклом. К концентрату присоединяют стеклянный переходник (черт. 1) с отростком и пробкой для ввода пробы.
Сосуд Дьюара стеклянный, вместимостью около 0,5 дм3.
Счетчик газовый барабанный (с жидкостным затвором) типа РГ-700.
Оборудование вспомогательное для хроматографического анализа:
лупа измерительная по ГОСТ 25706 16х увеличением с ценой деления ;
линейка металлическая по ГОСТ 427;
Стеклянный переходник с пробкой
Черт. 1
набор сит «Физприбор» или сита аналогичного типа; шприцы медицинские инъекционные типа Рекорд по ГОСТ 22967, вместимостью 2, 5, 10 см3;
секундомер механический;
расходомер пенный.
Кислород жидкий технический по ГОСТ 6331.
Гелий газообразный очищенный с объемной долей двуокиси углерода не более 0,0001 %.
Смесь поверочная газовая с объемной долей двуокиси углерода в азоте 0,50 % — ГСО № 3765-87 по Госреестру.
Уголь активный марки СКТ, фракция с частицами размером 0,2 — высушенный при 150 ??С в течение 4 ч.
Стекло лабораторное, измельченное в фарфоровой ступке. Фракцию с частицами размером 0,2 — промывают горячей дистиллированной водой и высушивают при 150 ??С в течение 4 ч.
Сетка медная с размером ячейки 0,1- или волокно стеклянное по ГОСТ 10727.
2. Подготовка к анализу
Газохроматографическую колонку наполняют активным углем; поверх слоя угля укладывают слой стеклянного волокна толщиной 8 — . Затем колонку укрепляют в термостате хроматографа и, не присоединяя к детектору, дополнительно высушивают при 150 ??С в течение 8 ч в токе газа-носителя при расходе 30 см3/мин.
Где применяется аргон?
Аргон получил большое распространение в промышленности. Инертные свойства этого газа особенно востребованы в различных производственных процессах, где необходимо вытеснить один из самых активных элементов – кислород. Использование аргона очень дёшево, в сравнении с другими инертными летучими веществами, поэтому газ незаменим в том случае, когда требуется защитная среда при сваривании металлов, а также вытеснение влаги и кислорода в ёмкостях, где хранятся пищевые продукты.
Наполнение колб ламп накаливания инертным газом, позволяет значительно увеличить ресурс работы осветительного прибора. Кроме повышенного срока использования такие элементы обладают большей яркостью. Используется инертный газ и при производстве люминесцентных ламп. Применение аргона позволяет облегчить запуск разряда электрической дуги, а также значительно увеличить ресурс электродов.
При изготовлении стеклопакетов, инертным газом заполняются полости между стёклами, что позволяет значительно улучшить теплоизоляционные свойства. Учитывая тот факт, что аргон является абсолютно прозрачным, использование его никак не ограниченно даже при изготовлении многослойных конструкций.


Инертный газ аргон используется также в установках плазменной резки металлов. Преимущество использования этого газа заключается в том, что для возникновения дуги не требуется слишком высокого напряжения, поэтому такие установки могут иметь очень простую конструкцию. При генерации плазмы с использованием аргона образуется минимальное количество вредных газообразных веществ во время выполнения резки, поэтому этот метод идеально подходит для ручных приборов.
Благодаря возможности образовывать плазму при относительно невысоком напряжении, этот благородный газ используется в медицине для проведения аргоновой коагуляции. Такой метод успешно используется для удаления новообразований, а также для остановки кровотечений.
Аргон применяется и в химической промышленности. Благодаря отсутствию взаимодействия с другими элементами этот газ используется для получения сверхчистых веществ, а также для их анализа. В металлургической промышленности благородный газ позволяет обрабатывать такие металлы, как: титан, тантал, ниобий, бериллий, цирконий и др. Кроме этого, газ используется для перемешивания расплавленных веществ и снижения окисления хрома при производстве хромированной стали.
Аргон: технические характеристики
Аргон представляет собой бесцветный газ, который не оказывает никакого действия на органы вкуса и обоняния. Этот одноатомный элемент является одним из самых распространённых инертных газообразных веществ на земле.
Аргон был открыт в конце XIX века британским учёным Джоном Стреттом. Исследователь проводил опыты по выделению азота из воздуха. В результате экспериментов было выяснено, что азот полученный таким образом имеет немного большую плотность, чем в случае, когда для получения этого газа использовались органические вещества. Учёный предположил, что азот из атмосферы содержит примесь неизвестного на тот момент газообразного вещества. Впоследствии, эти догадки были подтверждены, и аргон был получен в чистом виде и тщательно исследован.

Учёных, которые пытались произвести различные опыты с аргоном, ошеломил тот факт, что этот газ не вступал в реакцию с другими химическими элементами. Таким образом удалось впервые получить благородный газ с подобными характеристиками.
Несмотря на отсутствие соединений аргон, как и другие вещества, обладает физическими свойствами. К наиболее важным характеристикам газа относятся:
- Плотность: 1,784 кг/м3.
- Температура кипения: -185,8 ˚С.
- Тройная точка: -189,8˚С.
- Содержание в воздухе: 0,9% объёма.
Аргон практически не растворяется в воде, а также абсолютно безопасен в плане пожарной активности. Этот газ не ядовит, поэтому при работе с ним не требуется использовать каких-либо средств защиты.
Способы получения аргона
Аргон является третьим по распространённости газом в земной атмосфере, поэтому наиболее логичным способом является добывание его из воздуха. Для этой цели используются специальные низкотемпературные ректификационные аппараты.
Процесс отделения инертного вещества осуществляется в такой последовательности:
- Воздух очищается от пыли и подвергается сжатию до жидкого состояния.
- Жидкий воздух, состоящий преимущественно из кислорода, азота и аргона подвергается ректификации.
- После отделения азота, из получившейся при сжатии жидкости, осуществляется доочистка кислородно-аргоновой смеси.
Температура кипения аргона в ректификационной установке составляет минус 185,3˚С. При этом, кислород кипит при температуре на 3 градуса выше, а азот – на 13˚С ниже этого показателя. По причине небольшого отличия в переходе из одного агрегатного состояния в другое, на первом этапе отделения аргона смесь содержит большое количество жидкого кислорода. На заключительной стадии получения аргона производится отделение благородного газа из кислородно-аргоновой смеси. Процесс доочистки, как правило, осуществляется с помощью электролитического водорода. В результате реакции в контактном аппарате с кислородом образуется водяной пар, который затем утилизируется через влагоотделитель.
Аргон может быть получен не только из атмосферного воздуха. При некоторых производственных процессах этот газ может являться сопутствующим продуктом. Например, при производстве аммиака, аргон является примесью азота и является совершенно ненужным элементом, поэтому полученный таким образом газ имеет очень низкую себестоимость, в сравнении с криогенным аргоном.
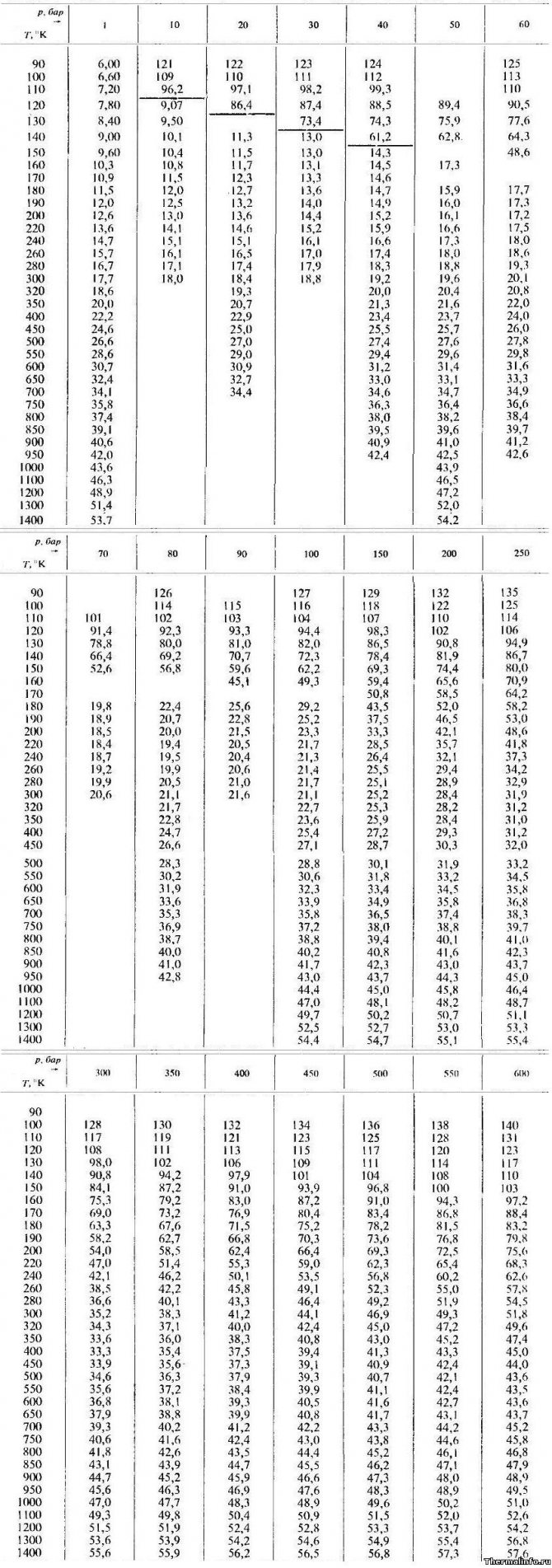
Теплопроводность аргона при различных температурах и давлениях
В таблице даны значения теплопроводности аргона в жидком и газообразном состояниях при различных температурах и давлениях. Теплопроводность указана при температуре от 90 до 1400 К и давлении от 1 до 600 атмосфер.
По данным таблицы максимальная теплопроводность аргона достигается при давлении 600 бар и температуре 100 К (теплопроводность равна 0,14 Вт/(м·град)). Примечание: Будьте внимательны! Теплопроводность указана в степени 103. Не забудьте разделить на 1000!

Меры безопасности
Применение технического газа аргона не требует специальных мер предосторожности. Этот газ обладает высокими экологическими свойствами. Это природный газ, который не претерпевает никаких технологических изменений. При этом аргон не отличается повышенной взрывоопасностью. Технология транспортировки и хранения газовых баллонов, наполненных аргоном, соответствует требованиям, применяемым для остальных технических газов.
Источники
- https://MetalListen.ru/raboty-s-metallami/argon-primenenie.html
- https://www.gaz-kom.ru/katalog/texnicheskie-gazyi/argon/
- https://himsnab-spb.ru/article/ps/ar/
- https://ballonis.ru/stati/gaz-argon-tehnicheskie-harakteristiki-i-primenenie