История открытия
Предыстория открытия Ar началась в 1785 году. Выдающийся ученый и естествоиспытатель из Великобритании Генри Кэвендиш исследовал состав воздуха. Он подвергал азот окислению и взвешивал получившиеся окислы. По окончании опыта в сосуде оставался газ. Кэвендиш определил его объем в 0,8% от начального объема воздуха.
Состав этого газа ученый определить не смог. Спустя столетие к проблеме вернулись сэры Джон Рэлей и Уильям Рэмзи. В ходе проведенных опытов они обнаружили, что азот, выделенный из воздуха, имеет большую плотность, нежели азот, получаемый в ходе реакции разложения нитрита аммония.
в 1884 году им удалось выделить из воздуха некий газ, более плотный, чем азот. Это вещество имело одноатомную молекулярную структуру и было крайне инертным — т.е. не реагировало с другими веществами.
На заседании Королевского Общества новому газу было присвоено название «аргон», что в переводе с древнегреческого значило «спокойный, ленивый»
Аргон в природе
Ввиду практически полной инертности Ar представлен в естественной среде исключительно в несвязанном виде. Его процентная доля в различных частях Земли равна приблизительно:
- земная кора — 0,00012%;
- морская вода — 0,00045%;
- атмосфера — 0,926%.
Доля Ar в воздухе выше, чем суммарная доля всех остальных инертных газов. Основным источником для его добычи служит наша атмосфера.
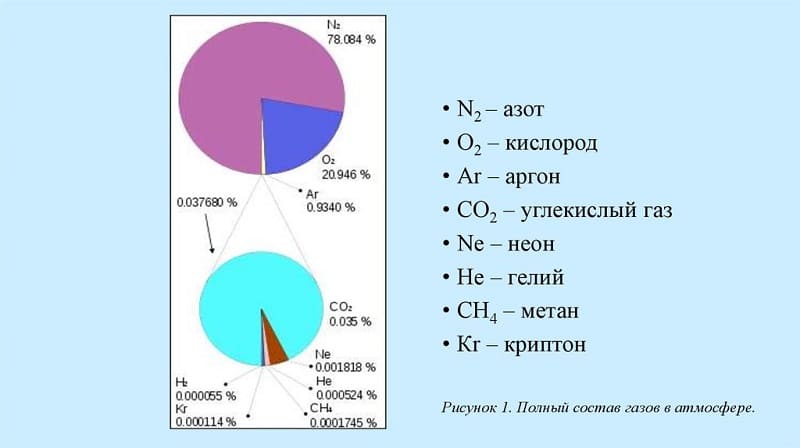
Содержание газов в атмосфере
В коре Земли аргон содержится также в виде радиоактивного изотопа Аргон-40 и появляется в ходе реакции распада изотопов Калия.
Современная наука вместе с остальными инертными газообразными элементами относит Ar к VIII группе периодической системы.
Меры предосторожности при эксплуатации
Данный химический элемент не представляет абсолютно никакой опасности для окружающей среды, но при большой концентрации оказывает удушающее воздействие на человека. Он нередко скапливается в районе пола в недостаточно проветриваемых помещениях, а при значительном уменьшении содержание кислорода может привести к потере сознания и даже смертельному исходу
Поэтому важно следить за концентрацией кислорода в закрытом помещении, которая не должна падать ниже 19%
Читать также: Для чего предназначены конвейеры
Еще мы советуем посмотреть третью часть обучения сварке в защитной среде аргона:
Жидкий Ar способен вызвать обморожение участков кожи и повредить слизистую оболочку глаз, поэтому в процессе работы важно использовать спецодежду и защитные очки. При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз
Заправить баллоны аргоном можно в , где соблюдается правильная технология заправки и предоставляется качественное обслуживание.
Если вы интересуетесь другими техническими газами, информацию можете найти здесь.
В атмосфере содержится около 0,9% аргона. Аргон, который, как и азот, представляет собой нейтральный бесцветный газ, существует в природе только в составе атмосферного воздуха. Он не пригоден для поддержания жизни, однако незаменим в некоторых технологических процессах благодаря высокому уровню химической инертности и относительной простоте извлечения.
Как добывают аргон
Благодаря значительному с промышленной точки зрения содержанию аргона в воздухе его получают в качестве дополнительного продукта криогенной ректификации O2 и N2.
Технология основана на том факте, что температура кипения (или сжижения) Ar лежит между температурами N2 и O2.
Перед началом процесса воздух подвергается тщательной очистке от пыли в многоступенчатых фильтрах, осушается от водяных паров, а далее мощными компрессорами сжимается до тех пор, пока не перейдет в жидкое состояние. Жидкость перегоняют в ректификационной колонне, чтобы разделить ее на отдельные вещества.


Установка для добычи аргона
Первым испаряется азот при -195 °С, его пары собираются на соответствующей тарелке ректификатора и отводятся в отдельный резервуар. Следующим по высоте (и при температуре кипения -185 °С) отбирается аргонная фракция, содержащая 12% Ar, менее полпроцента азота и кислород. Она подается в следующую ректификационную колонну, в которой процентная доля Ar доводится до 85, оставшееся приходится на кислород со следами азота. Такое вещество называется сырым аргоном, исходным материалом для получения очищенного газа.
В промышленности применяется несколько методов очистки сырого аргона от примесей.
Водород, добавляемый в состав сырья, окисляется на катализаторе и нагреве до 500 °С, таким образом, из состава смеси выводится кислород. Образовавшийся на катализаторе водяной пары удаляют при посредстве влагоотделителя. Газ после этого осушают. Аргон с оставшимся в нем азотом вновь ректифицируют.
Применяются и альтернативные методы получения Ar. Во время синтеза аммиака из азота и водорода в химических реакторах Ar получают как сопутствующий продукт производства. Технологический компонент это синтеза — продувочный газ — содержит до 20% Ar. Из этого газа и извлекают самый спокойный элемент. Стоимость производства, складывающаяся в основном из затрат на охлаждение и нагрев компонентов, делится между аммиаком и аргоном, и получается существенно ниже.
Качество газа, получаемого любым методом, определяется технологией очистки его от небольших количеств остаточного N2, O2, водяных паров и H2.


Аппарат, получающий ионные пучки аргона
Активные газы
Углекислый газ (двуокись углерода) – бесцветен, не ядовит, тяжелее воздуха. При нормальных условиях (760 мм рт. ст. и 0°С) плотность углекислого газа в 1,5 раза выше плотности воздуха. Углекислый газ хорошо растворяется в воде. Жидкая углекислота – бесцветная жидкость, плотность которой сильно изменяется с изменением температуры. Вследствие этого она поставляется по массе, а не по объему. При испарении 1 кг жидкой углекислоты в нормальных условиях образуется 509 л углекислого газа.
Двуокись углерода нетоксична и невзрывоопасна. Однако при концентрациях более 5% (92 г/м3) двуокись углерода оказывает вредное влияние на здоровье человека. Так как двуокись углерода в 1,5 раз тяжелее воздуха она может накапливаться в слабопроветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать удушье. Помещения, где производится сварка с использованием двуокиси углерода, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией.
Основными примесями углекислого газа, отрицательно влияющими на процесс сварки и свойства швов, являются воздух (азот воздуха) и вода. Воздух скапливается над жидкой углекислотой в верхней части баллона, а вода – под углекислотой в нижней части баллона. Повышенное содержание воздуха и водяных паров в углекислоте может при сварке привести к образованию пор в швах, которые чаще всего появляются в начале и конце отбора газа из баллона. Чтобы снизить содержание влаги в поступающем на сварку углекислом газе до безопасного уровня, на его пути устанавливают осушитель. Для улавливания влаги осушитель заполнен хлористым кальцием, силикагелем или другими поглотителями влаги.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой углекислоты газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом. Во избежание этого рекомендуется подогревать выходящий из баллона углекислый газ. Для этого используют электрические подогреватели газа, которые устанавливаются перед редуктором.
Углекислый газ оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие. Из легирующих элементов ванны наиболее сильно окисляются алюминий, титан и цирконий, менее интенсивно – кремний, марганец, хром, ванадий и др.
Кислород – это бесцветный нетоксичный газ без запаха. Является сильным окислителем. Накопление кислорода в воздухе помещений создает опасность возникновения пожаров. Поэтому объемная доля кислорода в рабочих помещениях не должна превышать 23 %. В зависимости от содержания кислорода и примесей технический газообразный кислород изготовляют трех сортов. Содержание кислорода в первом сорте должно быть не менее 99,7 об. %, во втором – не менее 99,5 об. % и в третьем – не менее 99,2 об. %.
В сварочном производстве кислород широко применяют для газовой сварки и резки, а также при дуговой сварке как составную часть защитной газовой смеси. Кислород уменьшает поверхностное натяжение металла, и поэтому с увеличением его содержания в смеси на основе аргона критический ток (перехода крупнокапельного переноса в мелкокапельный, см. Сварка плавящимся металлическим электродом в защитных газах (МIG/МАG)) уменьшается. Обычно содержание кислорода в смеси с аргоном не превышает 2-5%. В такой среде дуга горит стабильно. Перенос металла мелкокапельный с минимальным разбрызгиванием.
Азот – бесцветный газ, без запаха, не горит и не поддерживает горение. В сварочном производстве азот находит ограниченное применение. Азот не растворяется в расплавленной меди и не взаимодействует с ней, и поэтому может быть использован при сварке меди в качестве защитного газа. По отношению к большинству других металлов азот является активным газом, часто вредным, и его концентрацию в зоне плавления стремятся ограничить. Азот также применяется при плазменной резке и как компонент газовой смеси при сварке аустенитной нержавеющей стали.
Водород – не имеет цвета, запаха и является горючим газом. Водород редко используют в в качестве защитного газа. Так как смеси водорода с воздухом или кислородом взрывоопасны, при работе с ним необходимо соблюдать правила пожарной безопасности и специальные правила техники безопасности. При работе с водородом необходимо следить за герметичностью всех соединений, т.к. он образовывает с воздухом взрывчатые смеси в широких пределах.
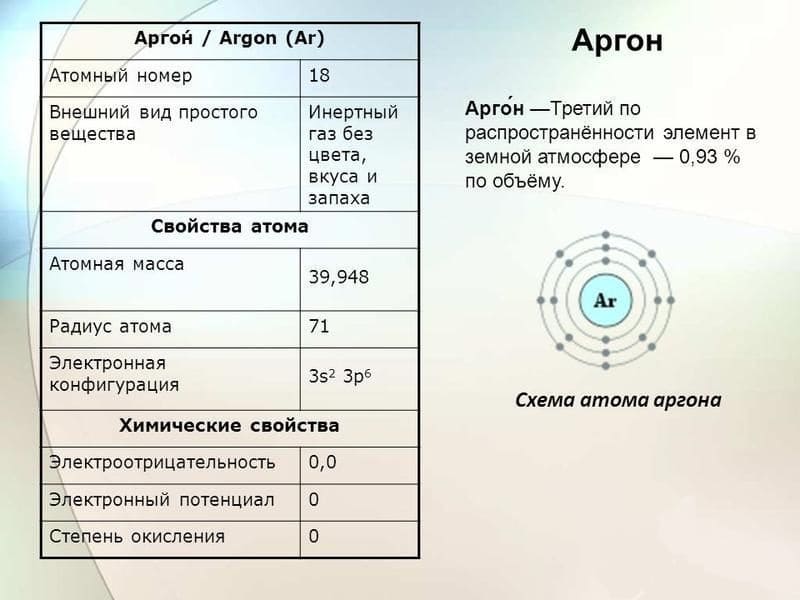
Общая характеристика Ar
Ar входит в группу инертных газов. Заряд его ядра — 18, под таким же номером элемент располагается в таблице Менделеева.
Из всех участников VIIIA группы он является наиболее часто встречающимся в природе. Объемная доля Ar в атмосфере -0,93%, массовая доля составляет 1,28%.Элемент является газом без цвета, вкуса и запаха. Химически не активен – аргон не вступает в реакцию и практически не соединяется ни с какими элементами или веществами, за исключением CU(Ar)O, и гидрофторида аргона.
Весьма плохо растворим водой, чуть большая растворимость наблюдается при взаимодействии с органическими растворителям.
Виды аргона
Говоря о видах, или сортах Ar, надо понимать, что это одно и то же химическое вещество. Виды различаются по степени очистки от примесей.
- Высший сорт. Содержание Ar не менее 99,99% . Этот сорт особо высокой чистоты применяется для ответственных сварочных работ, таких, как сварка материалов, химически активных в нагретом состоянии: некоторые цветные сплавы, прежде всего титановые, нержавеющая сталь и др. Используется также для сварки высоконагруженных изделий из конструкционной стали.
- Первый сорт. Содержание Ar не менее 99,98%, Применяется при сварке сплавов на основе алюминия с другими металлами и сплавами, для менее активных цветных металлов.
- Второй сорт. Содержание Ar не менее 99,95%. Используется при сваривании деталей из жаростойких стальных сплавов, алюминия и конструкционных сталей. Применение чистого Ar в этих случаях нежелательно, поскольку приводит к повышенной пористости материала шва и не позволяет защитить сварочную ванну от повышенной влажности и других загрязнений. Во избежание возникновения такого дефекта в состав смеси защитных газов добавляют углекислый газ и кислород, связывающие выделяющийся при сварке водород и другие примеси. Образующиеся в ходе этих реакций шлаки всплывают на поверхность сварочной ванны и после застывания удаляются вместе с окалиной.
Смеси защитных газов
Иногда является целесообразным употребление газовых смесей. За счет добавок активных газов к инертным удается повысить устойчивость дуги, увеличить глубину проплавления, улучшить формирование шва, уменьшить разбрызгивание, повысить плотность металла шва, улучшить перенос металла в дуге, повысить производительность сварки. Существенное значение при выборе состава защитного газа имеют экономические соображения.
Смесь аргона и гелия. Газовые смеси гелий-аргон применяются в основном для сварки цветных металлов: алюминий, медь, никелевых и магниевых сплавов, а также химически активных металлов. Оптимальным является соотношение 35 – 40% аргона и 60 – 65% гелия. Так в полной мере реализуются преимущества обоих газов: аргон обеспечивает стабильность дуги, гелий – высокую глубину проплавления.
Смеси аргона с кислородом или углекислым газом. Благодаря добавке окислительных газов обеспечивается существенное снижение поверхностного натяжения жидкого металла расплавляемой электродной проволоки, уменьшение размеров образующихся и отрывающихся от электрода капель. Расширяется диапазон токов при сохранении стабильного ведения процесса сварки. Обеспечивается лучшее формирование металла шва и меньшее разбрызгивание, лучшая форма провара и меньшее излучение дуги, по сравнению со сваркой в чистом аргоне, а также в чистом углекислом газе. При добавлении кислорода наблюдается снижение критического тока, при котором крупнокапельный перенос металла переходит в мелкокапельный.
В таблице ниже приводятся основные характеристики газовых смесей для сварки МИГ/МАГ.
| Толщина металла | Вид переноса | Рекомендуемый защитный газ | Достоинства |
| Углеродистые стали | |||
| До 2 мм. | С короткими замыканиями | Ar + СО2 Ar + СО2 + О2 | Легкое управление ванной при сварке во всех пространственных положениях. Хорошее проплавление. |
| 2 – 3 мм | Ar + (8…25)% СО2 Ar + He + СО2 | ||
| Более 3 мм | СО2 Ar + (15…25)% СО2 | ||
| Ar + 25% СО2 | Подходит для больших токов и высоких скоростей сварки | ||
| Ar + 50% СО2 | Применяется при сварке во всех пространственных положениях. Обеспечивает глубокое проплавление. Допускает высокие скорости сварки. | ||
| СО2 | Глубокое проплавление и высокая скорость сварки (однако, возможны прожоги). | ||
| Струйный | Ar + (1…8)% СО2 | Высокая стабильность дуги. Хорошее сплавление, внешний вид и форма шва. Легкое управление ванной. | |
| Более 2 мм | Импульсный | Ar + (2…8)% О2 Ar + (5…20)% СО2 | Стабильный управляемый мелкокапельный перенос. |
| Низко- и высоколегированные стали | |||
| До 2,5 мм | С короткими замыканиями | Ar + (8…20)% СО2 | Высокая стабильность дуги. Хорошее сплавление, внешний вид и форма шва. Легкое управление ванной. |
| Более 2,5 мм | Струйный | Ar + 2% О2 Ar + (5…10)% СО2 | Снижение вероятности подрезов. Глубокое проплавление и хорошие механические свойства шва. |
| Импульсный | Ar + 2% О2 Ar + 5% СО2 | Стабильный управляемый мелкокапельный перенос. | |
| Нержавеющая сталь, никель, никелевые сплавы | |||
| До 2 мм | С короткими замыканиями | Ar + (2…5)% СО2 | Легкое управление ванной. Предупреждает возникновения прожогов. |
| Более 2 мм | Ar + (2…5)% СО2 | Низкое содержание СО2 в смеси уменьшает науглероживание, которое может способствовать возникновению межкристаллитной коррозии в некоторых сплавах. Применяется для всех положений сварки. | |
| Струйный | Ar + (1…2)% О2 Ar + (2…5)% СО2 | Хорошая стабильность дуги. Низкая вероятность подрезов. | |
| Более 2 мм | Импульсный | Ar + (1…2)% О2 | Стабильный управляемый перенос в широком диапазоне режимов сварки. |
| Медь, медно-никелевые сплавы | |||
| До 3 мм | С короткими замыканиями | He + 10% Ar He + 25% Ar Ar + He | Хорошая стабильность дуги и легко управляемая сварочная ванна. |
| Более 3 мм | Струйный | He + Ar He или Ar | Высокое тепловложение. Сварка в чистом гелии применяется для больших толщин. |
| Импульсный | He или Ar | Стабильный управляемый мелкокапельный перенос. | |
| Алюминий | |||
| До 12 мм | Струйный, Импульсный | Ar | Стабильная дуга и перенос металла. Разбрызгивание незначительное или отсутствует. |
| Более 12 мм | He + (20…50)% Ar Ar + He | Высокое тепловложение. Хорошее проплавление. Минимальная пористость. | |
| Магний, титан и другие, химически активные металлы | |||
| Весь диапазон толщин | Струйный | Ar | Обеспечивается более стабильная дуга, чем в смесях, где преобладает гелий |
| Ar + (20…70)% He | Более высокое тепловложение и сниженная вероятность возникновения пористости. |
Физические и химические свойства
Свойства аргона типичны для члена VIII группы.
При обычной температуре Ar пребывает в газообразном состоянии. Молекула включает в себя единственный атома, химическая формула весьма простая: Ar. Температура кипения весьма низка : -185,8 °С при атмосферном уровне давления.
Растворимость в воде низкая — всего 3,29 мл на 100 мл жидкости
Плотность аргона при нормальных условиях составляет 1,78 кг/м3. Молярная теплоемкость газа- 20,7 Дж/Кмоль.
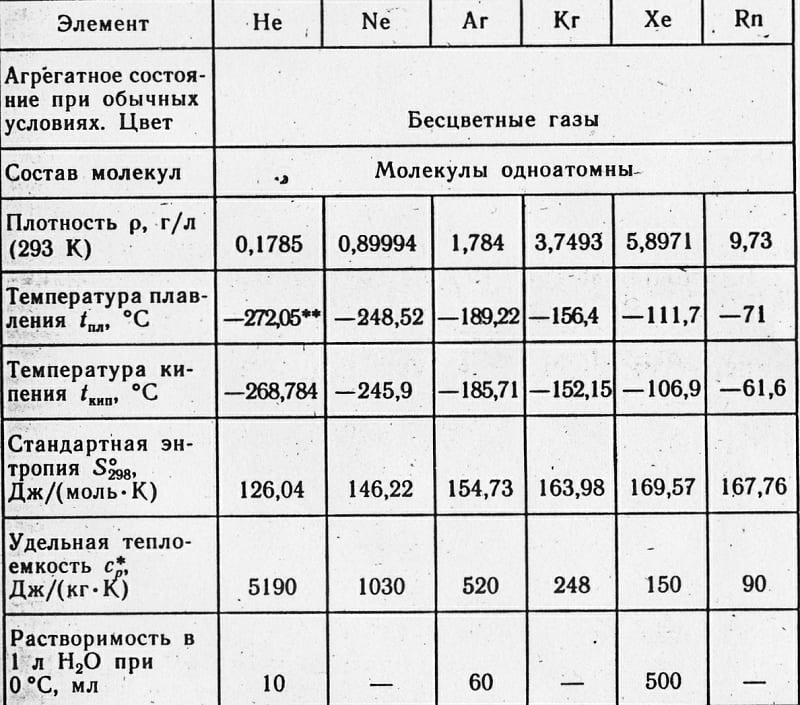

Характеристики аргона и других инертных газов
Газ практически полностью инертен. На сегодняшний день ученым удалось получить лишь два его соединения — CU(Ar)O, и гидрофторид аргона. Соединения существуют лишь при сверхнизких температурах. Предполагается, что Ar может входить в состав неустойчивых в нормальном состоянии молекул эксимерного типа. Такие молекулы могут существовать лишь в возбужденном состоянии, например, в ходе электроразряда высокой интенсивности. Такие соединения возможны с ртутью, кислородом и фтором.
Электроотрицательность по шкале Полинга равна 4,3.
Как степень окисления, так и электродный потенциал имеют нулевое значение, что характерно для инертного газа.
Ионный радиус составляет 154, радиус ковалентности — 106 Пм. Ионизационный порог- 1519 кдж/моль
Атомная и молекулярная масса
Такие важные параметры, как атомная и молекулярная массы, показывают, насколько масса молекулы вещества и масса его атома соответственно превышают значение, равное одной двенадцатой доле массы атома водорода.
Ввиду того, что молекула Ar состоит из единственного атома, молекулярная и атомная масса аргона идентичны и составляют 39,984.

Структура аргона и его свойства
Изотопы
В природных условиях Ar встречается в качестве трех устойчивых изотопов
- 36Ar– процентная доля этого изотопа составляет 0,337% в ядре 18 протонов и 18 нейтронов;
- 38Ar- его доля всего 0,063%, в ядре 18 протонов и 20 нейтронов;
- 40Ar – наиболее распространен, его доля составляет 99,6%, в ядре так же 18 протонов, но уже 22 нейтрона.
Искусственным путем удавалось получать изотопы с массовым индексом от 32 до 55, наиболее стабильным из них оказался 39Ar, период полураспада которого составляет 268 лет.
Большая процентная доля 40Ar среди изотопов, встречающихся в природе, вызвана постоянным образованием его в ходе реакции распада изотопа калий-40. На 1000 кг калия в ходе таких реакций за год образуется не более 3100 атомов 40Ar. Но, поскольку эти реакции идут постоянно в течение сотен миллионов лет, изотоп накопился в природе в существенных объемах.
Доминирование тяжелого изотопа в природе обуславливает тот факт, что атомный вес Ar превышает атомный вес калия, находящегося в таблице следом за ним. При создании Периодической системы такого противоречия не было, поскольку аргон был обнаружен и свойства его были исследованы значительно позже, в первом десятилетии XX века. Первоначально Ar был помещен в первую группу таблицы, восьмая группа была выделена позднее.
Ионы
Как и другие инертные газы (такие, как He и Ne), Ar подвержен ионизации. При возбуждении атомов и сообщении им высоких энергий возникают молекулярные ионы Ar2+.
Молекула и атом
Для инертных газов эти понятия идентичны, поскольку эти элементы не желают вступать в химическую связь даже с себе подобными. Молекула включает в себя один атом, химическая формула газа не отличается от обозначения элемента: Ar.
Молярная масса
Молярная масса аргона составляет 39,95 г/моль.
Существуют несколько методов ее вычисления:
- С применением относительной атомной массы M и коэффициента пропорциональности к, выражающего соотношение между относительной массой и молярной. Этот коэффициент является универсальной константой и равен для всех элементов. Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.
- С использованием молярного объема. Потребуется найти объем, занимаемый при обычных условиях некоторой массой газа, далее рассчитать массу 22,4 литров вещества при таких же условиях.
- С применением уравнения Менделеева-Клапейрона, моделирующего идеальный газ.
pV = mRT / M,
проведя преобразования, получим выражение для молярной массы:
M=mRT/pV
где
- p – давление в паскалях,
- V –объем в кубометрах
- m – масса в граммах,
- Т — температура в Кельвинах,
- R – константа, значение которой 8,314 Дж/(моль×К).
Таблица молярных масс химических элементов (2 часть):
| 31 | Галлий | Ga | 69,723(1) а.е.м. (г/моль) |
| 32 | Германий | Ge | 72,630(8) а.е.м. (г/моль) |
| 33 | Мышьяк | As | 74,92160(2) а.е.м. (г/моль) |
| 34 | Селен | Se | 78,96(3) а.е.м. (г/моль) |
| 35 | Бром | Br | 79,901-79,907 а.е.м. (г/моль) |
| 36 | Криптон | Kr | 83,798(2) а.е.м. (г/моль) |
| 37 | Рубидий | Rb | 85,4678(3) а.е.м. (г/моль) |
| 38 | Стронций | Sr | 87,62(1) а.е.м. (г/моль) |
| 39 | Иттрий | Y | 88,90585(2) а.е.м. (г/моль) |
| 40 | Цирконий | Zr | 91,224(2) а.е.м. (г/моль) |
| 41 | Ниобий | Nb | 92,90638(2) а.е.м. (г/моль) |
| 42 | Молибден | Mo | 95,96(2) а.е.м. (г/моль) |
| 43 | Технеций | Tc | 97,9072 а.е.м. (г/моль) |
| 44 | Рутений | Ru | 101,07(2) а.е.м. (г/моль) |
| 45 | Родий | Rh | 102,90550(2) а.е.м. (г/моль) |
| 46 | Палладий | Pd | 106,42(1) а.е.м. (г/моль) |
| 47 | Серебро | Ag | 107,8682(2) а.е.м. (г/моль) |
| 48 | Кадмий | Cd | 112,411(8) а.е.м. (г/моль) |
| 49 | Индий | In | 114,818(1) а.е.м. (г/моль) |
| 50 | Олово | Sn | 118,710(7) а.е.м. (г/моль) |
| 51 | Сурьма | Sb | 121,760(1) а.е.м. (г/моль) |
| 52 | Теллур | Te | 127,60(3) а.е.м. (г/моль) |
| 53 | Йод | I | 126,90447(3) а.е.м. (г/моль) |
| 54 | Ксенон | Xe | 131,293(6) а.е.м. (г/моль) |
| 55 | Цезий | Cs | 132,9054519(2) а.е.м. (г/моль) |
| 56 | Барий | Ba | 137,327(7) а.е.м. (г/моль) |
| 57 | Лантан | La | 138,90547(7) а.е.м. (г/моль) |
| 58 | Церий | Ce | 140,116(1) а.е.м. (г/моль) |
| 59 | Празеодим | Pr | 140,90765(2) а.е.м. (г/моль) |
| 60 | Неодим | Nd | 144,242(3) а.е.м. (г/моль) |
Область применения
Шире всего аргон применяется при сварочных работах. Он используется для создания защитной атмосферы вокруг сварочной ванны, вытесняя из рабочей зоны O2 и N2, содержащиеся в атмосфере. Особенно важно это для сварки цветных металлов, многие из которых, к примеру, Ti, отличаются высокой химической активностью в нагретом состоянии. Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Также широко применяется при монтаже высоконагруженных строительных конструкций, таких, как каркасы высотных зданий, фермы мостов и многих других. Здесь его применение обеспечивает высокое качество, однородность и долговечность ответственных соединений. В строительной индустрии аргонная сварка доминирует среди других методов.


Сварка аргоном
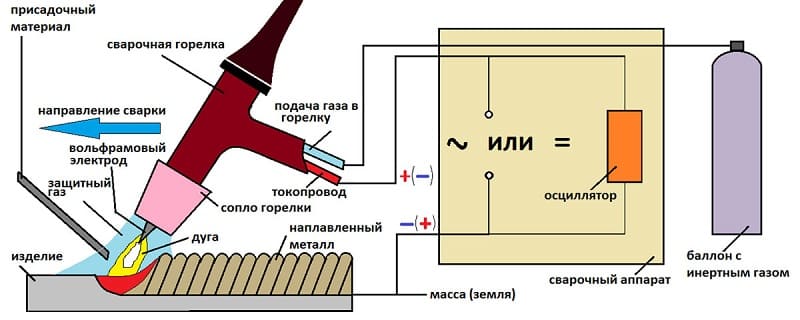

Аргонно-дуговая сварка
Не менее широко применяется аргонная сварка в машиностроении, прежде всего химическом и пищевом. Швы получаются долговечные и надежные, даже в условиях воздействия агрессивных сред.
Нефтяная и газовая отрасли также применяют аргонная сварку при монтаже трубопроводов, газоперекачивающих станций и нефтеперегонных комбинатов.
Используется метод также в атомной промышленности, в транспортном машиностроении и в аэрокосмической отрасли.
В домохозяйствах аргонная сварка распространена не так широко. Это объясняется:
- высокой стоимостью оборудования и расходных материалов;
- необходимостью достаточной квалификации сварщика;
- меньшими нагрузками, испытываемыми домашними конструкциями;
- более низкими требованиями к прочности и долговечности сварных соединений.
Если в домохозяйстве возникает эпизодическая потребность в таких сварочных работах, то дешевле, быстрее и надежнее пригласить сварщика-специалиста.


Стеклопакет с аргоном
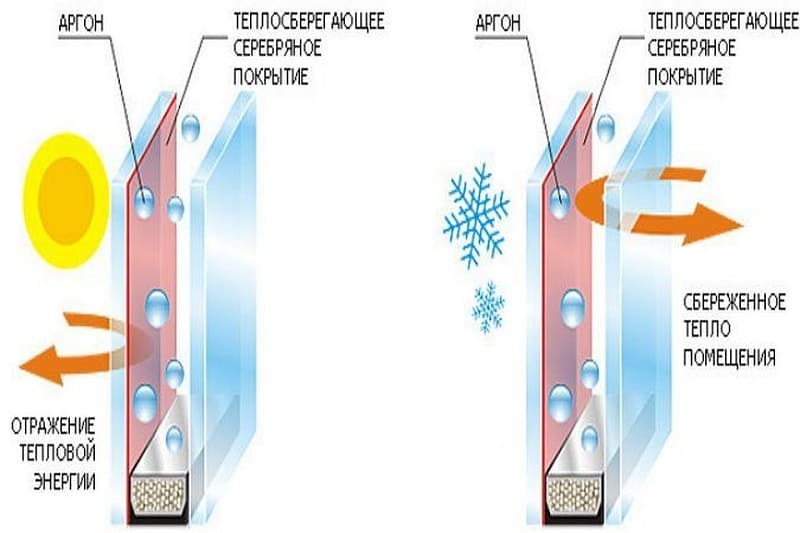

Принцип действия стеклопакета с аргоном
Характерным свойством Ar является его более высокая плотность по сравнению с воздухом. Поэтому максимальная эффективность аргонной сварки достигается при нижнем сварочном положении. В этом случае инертный раз растекается по поверхности детали и образует защитное облако значительной протяженности, позволяя вести сварку, как большими токами, так и на большой скорости. При сварке в наклонном и верхнем положении приходится учитывать «проваливание» аргона сквозь воздух. Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Поскольку потенциал ионизации Ar невысок, его использование обеспечивает идеальные геометрических характеристик сварочного шва, прежде всего, профиля. Возбужденная электродуга в аргоновой атмосфере также отличается высокой стабильностью своих параметров. С другой стороны, низкое значение потенциала ионизации обуславливает и более низкое напряжение розжига и поддержания дуги. Это сокращает ее тепловыделение и усложняет провар толстых листов металла.
Более высокая температура дуги в аргоновой атмосфере существенно повышает проплав сварочного шва. Это позволяет проводить сварку за один проход при условии точного соблюдения параметров зазора между заготовками.
В случае применения TIG-метода сварочных работ аргоновая атмосфера защищает от коррозионного влияния не только зону сварки, но и окончание неплавкого электрода.
В ряде специфических случаев в состав защитной газовой смеси добавляют гелий.
Кроме применения при сварочных работах, аргон используется:
- Как плазмоообразующее веществона установках плазменного раскроя металла.
- Для создания инертной среды в упаковках пищевых продуктов. Он вытесняет из пакетов и контейнеров кислород воздуха и водяные пары, пагубно влияющие на срок годности продуктов. Продукты в защитной атмосфере хранятся в несколько раз дольше, чем в обычной упаковке. Применяется этот метод и для упаковки медицинских изделий и препаратов, позволяя сохранить их в должной стерильности и химической чистоте.
- В качестве активного агента в противопожарных установках. Аргон вытесняет кислород (или другой газ) из очага горения, прекращая его.
- Для создания защитной среды в технологических установках при обработке полупроводниковых устройств, создании микросхем и других электронных компонентов или материалов высоких степеней чистоты.
- Наполнитель электроламп.
- В рекламных люминесцентных трубках.
Применение[ | ]
Заполненная аргоном и парами ртути газоразрядная трубка Ниже перечислены области применения аргона:
- в аргоновых лазерах;
- в качестве газонаполнителя ламп накаливания и при заполнении внутреннего пространства стеклопакетов;
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов (например, титана), так и неметаллов;
- в качестве плазмы в плазматронах при сварке и резке;
- в пищевой промышленности в качестве пищевой добавки E938
, в качестве пропеллента и упаковочного газа; - в качестве огнетушащего вещества в газовых установках пожаротушения;
- в медицине во время операций для очистки воздуха и разрезов, так как аргон не образует химических соединений при комнатной температуре;
- в качестве составной части атмосферы эксперимента «Марс-500» с целью снижения уровня кислорода для предотвращения пожара на борту космического корабля при путешествии на Марс;
- в дайвинге из-за низкой теплопроводности аргон применяется для поддува сухих гидрокостюмов, однако есть ряд недостатков, например, высокая цена газа (кроме этого, нужна отдельная система для аргона);
- в химическом синтезе для создания инертной атмосферы при работе с нестабильными на воздухе соединениями.
Зависимость давления аргона в баллоне от температуры
По мере нагрева давление газообразного вещества в замкнутом объеме повышается. В таблице приведены примерные значения давления в баллоне в зависимости от температуры окружающего воздуха.
| T, °C | P, Мегапаскаль |
| -40 | 10,45 |
| -30 | 11,33 |
| -20 | 12,21 |
| -10 | 12,92 |
| 0 | 13,74 |
| +10 | 14,62 |
| +20 | 15,33 |
| +30 | 16,03 |
Следует учитывать, что баллонное давление изменяется не мгновенно, а по мере его прогрева или охлаждения.
Таблица молярных масс химических элементов (3 часть):
| 61 | Прометий | Pm | 144,9127 а.е.м. (г/моль) |
| 62 | Самарий | Sm | 150,36(2) а.е.м. (г/моль) |
| 63 | Европий | Eu | 151,964(1) а.е.м. (г/моль) |
| 64 | Гадолиний | Gd | 157,25(3) а.е.м. (г/моль) |
| 65 | Тербий | Tb | 158,92535(2) а.е.м. (г/моль) |
| 66 | Диспрозий | Dy | 162,500(1) а.е.м. (г/моль) |
| 67 | Гольмий | Ho | 164,93032(2) а.е.м. (г/моль) |
| 68 | Эрбий | Er | 167,259(3) а.е.м. (г/моль) |
| 69 | Тулий | Tm | 168,93421(2) а.е.м. (г/моль) |
| 70 | Иттербий | Yb | 173,045(10) а.е.м. (г/моль) |
| 71 | Лютеций | Lu | 174,9668(1) а.е.м. (г/моль) |
| 72 | Гафний | Hf | 178,49(2) а.е.м. (г/моль) |
| 73 | Тантал | Ta | 180,94788(2) а.е.м. (г/моль) |
| 74 | Вольфрам | W | 183,84(1) а.е.м. (г/моль) |
| 75 | Рений | Re | 186,207(1) а.е.м. (г/моль) |
| 76 | Осмий | Os | 190,23(3) а.е.м. (г/моль) |
| 77 | Иридий | Ir | 192,217(3) а.е.м. (г/моль) |
| 78 | Платина | Pt | 195,084(9) а.е.м. (г/моль) |
| 79 | Золото | Au | 196,966569(4) а.е.м. (г/моль) |
| 80 | Ртуть | Hg | 200,592(3) а.е.м. (г/моль) |
| 81 | Таллий | Tl | 204,382-204,385 а.е.м. (г/моль) |
| 82 | Свинец | Pb | 207,2(1) а.е.м. (г/моль) |
| 83 | Висмут | Bi | 208,98040(1) а.е.м. (г/моль) |
| 84 | Полоний | Po | 208,9824 а.е.м. (г/моль) |
| 85 | Астат | At | 209,9871 а.е.м. (г/моль) |
| 86 | Радон | Rn | 222,0176 а.е.м. (г/моль) |
| 87 | Франций | Fr | 223,0197 а.е.м. (г/моль) |
| 88 | Радий | Ra | 226,0254 а.е.м. (г/моль) |
| 89 | Актиний | Ac | 227,0278 а.е.м. (г/моль) |
| 90 | Торий | Th | 232,03806(2) а.е.м. (г/моль) |
| 91 | Протактиний | Pa | 231,03588(2) а.е.м. (г/моль) |
| 92 | Уран | U | 238,02891(3) а.е.м. (г/моль) |
| 93 | Нептуний | Np | 237,0482 а.е.м. (г/моль) |
| 94 | Плутоний | Pu | 244,0642 а.е.м. (г/моль) |
| 95 | Америций | Am | 243,061375 а.е.м. (г/моль) |
| 96 | Кюрий | Cm | 247,0703 а.е.м. (г/моль) |
| 97 | Берклий | Bk | 247,0703 а.е.м. (г/моль) |
| 98 | Калифорний | Cf | 251,0796 а.е.м. (г/моль) |
| 99 | Эйнштейний | Es | 252,083 а.е.м. (г/моль) |
| 100 | Фермий | Fm | 257,0951 а.е.м. (г/моль) |
| 101 | Менделевий | Md | 258,1 а.е.м. (г/моль) |
| 102 | Нобелий | No | 259,1009 а.е.м. (г/моль) |
| 103 | Лоуренсий | Lr | 266 а.е.м. (г/моль) |
| 104 | Резерфордий (Курчатовий) | Rf | 267 а.е.м. (г/моль) |
| 105 | Дубний (Нильсборий) | Db | 268 а.е.м. (г/моль) |
| 106 | Сиборгий | Sg | 269 а.е.м. (г/моль) |
| 107 | Борий | Bh | 270 а.е.м. (г/моль) |
| 108 | Хассий | Hs | 269 а. е. м. (г/моль) |
| 109 | Мейтнерий | Mt | 278 а. е. м. (г/моль) |
| 110 | Дармштадтий | Ds | 281 а. е. м. (г/моль) |
Коэффициент востребованности 7 063