Изначально ученые думали, что все горючие материалы содержат в себе особое вещество – «флогистон», мол именно из-за него происходит процесс горения. Однако в XVIII веке химики выяснили, что в действительности нет никакого таинственного элемента, а причиной горения огня является кислород. Опытным путем было доказано, что пламя – это следствие от взаимодействия горючего материала с окислителем.
Прежде чем мы перейдем к температуре горения, важно познакомиться с физикой процесса горения и изучить фазы этого процесса.
Виды пламени
Свечение огня делится на два вида:
Почти каждое свечение видимо для человеческого глаза, но не каждое способно испускать нужное количество светового потока.
Свечение пламени обуславливается следующими факторами.
- Температурой.
- Плотностью и давлением газов, которые участвуют в реакции.
- Наличием твёрдого вещества.
Наиболее общая причина свечения — это присутствие в пламени твёрдого вещества.
Многие газы горят слабо светящимся или несветящимся пламенем. Из них наиболее распространены сероводород (пламя голубого цвета как при горении), аммиак (бледно-жёлтое), метан, окись углерода (пламя бледно-голубого цвета), водород. Пары летучих некоторых жидкостей горят едва светящимся пламенем (спирт и сероуглерод), а пламя ацетона и эфира становится немного коптящим из-за небольшого выделения углерода.
Разнообразие типов костров и особенности каждого из них
На сегодняшний день известно большое разнообразие костров, многие из которых пользуются популярностью в среде туристов, охотников и людей, интересующихся вопросами выживания в дикой природе. Наиболее известны из них: шалаш (он же — пионерский), колодец, финская свеча, дакотский очаг, таежный и нодья.

Костер Шалаш
Такое разнообразие связано в первую очередь с тем, что не существует одного универсального костра, которым можно было бы с эффективностью пользоваться при любых условиях. У каждого костра есть своя область применения, свои достоинства и недостатки, выделяющие его среди остальных типов.
Так одни костры (например, финская свеча) хороши для освещения и приготовления еды, другие (например, нодья) — для обогрева, а третьи (например, дакотский очаг) представляют собой закрытый от посторонних глаз костер, позволяющий лучше остальных скрыть свое местонахождение.
Отдельно мы рассматривали наиболее популярные виды костров, их плюсы и минусы, а также области применения.
Температура пламени
Для разных горючих паров и газов температура пламени неодинакова. А ещё неодинакова температура разных частей пламени, а область полного сгорания имеет более высокие показатели температуры.
Некоторое количество горючего вещества при сжигании выделяет определённое количество теплоты. Если строение вещества известно, то можно рассчитать объём и состав полученных продуктов горения. А если знать удельную теплоту этих веществ, то можно рассчитать ту максимальную температуру, которую достигнет пламя.
Стоит помнить о том, что если вещество горит в воздухе, то на каждый объём вступающего в реакцию кислорода приходится четыре объёма инертного азота. А так как в пламени присутствует азот, он нагревается теплотой, которая выделяется при реакции. Исходя из этого можно сделать вывод о том, что температура пламени будет состоять из температуры продуктов горения и азота.
Невозможно точно определить температуру, но можно это сделать приблизительно, так как удельная теплота изменяется с температурой.
Вот некоторые показатели по температуре открытого огня в разных материалах.
- Горение магния — 2200 градусов.
- Горение спирта не превышает температуры 900 градусов.
- Горение бензина — 1300−1400 градусов.
- Керосина — 800, а в среде чистого кислорода — 2000 градусов.
- Горение пропан-бутана может достигать температуры от 800 до 1970 градусов.
- При сгорании дерева температурный показатель колеблется от 800 до 1000 градусов, а воспламеняется оно при 300 градусах.
- Температурный параметр горения спички составляет 750−850 градусов.
- В горящей сигарете — от 700 до 800 градусов.
- Большинство твёрдых материалов воспламеняется при температурном показателе в 300 градусов.
Как тушить костер
Умение правильно тушить костер зачастую не менее важно, чем умение его разводить. Забытые в золе тлеющие головни могут привести к пожару. Поэтому всегда следует с полной ответственностью подходить к этому, казалось бы, простому и на первый взгляд безопасному вопросу.
Для тушение костра эффективнее всего использовать воду. Угли отодвигаются друг от друга и заливаются водой. Если костер оставить в сложенном состоянии, тушение может не возыметь должного эффекта, и вроде бы потухшие угли быстро высохнут, нагреют друг друга и заново воспламенятся. Это особенно актуально для таких костров, как «охотничье корыто».
Если костер состоит из толстых бревен, их можно попытаться окунуть в водоем или глубокую лужу. Это надежный способ для тушения таких костров, как нодья.
Когда водоема поблизости нет, на костер можно помочиться. А если размеры костра не позволяют потушить угли таким количеством жидкости, тогда следует либо дождаться полного остывания тлеющих головней, либо при необходимости срочно выходить с места стоянки присыпать их толстым слоем песка или земли: недостаток кислорода не даст древесине загореться повторно.
Однако не стоит мочиться в костер, организованный на месте централизованной стоянки: после этим же костровищем могут пользоваться и другие люди. Не думаю, что кому-то было бы приятно разводить костер и готовить еду на месте бывшего туалета.
Пламя свечи
Пламя, которое каждый человек может наблюдать при горении свечи, спички или зажигалки, представляет из себя поток раскалённых газов, которые вытягиваются вертикально вверх, благодаря силе Архимеда. Фитиль свечи вначале нагревается и начинает испаряться парафин. Для самой нижней части характерно небольшое свечение синего цвета — там мало кислорода и много топлива. Именно из-за этого топливо не полностью сгорает и образуется оксид углерода, который при окислении на самом крае конуса пламени ему придаёт синий цвет.
За счёт диффузии в центр поступает немного больше кислорода. Там происходит последующее окисление топлива и температурный показатель растёт. Но для полного сгорания топлива этого недостаточно. Внизу и в центре содержатся частицы угля и несгоревшие капельки. Они светятся из-за сильного нагревания. А вот испарившееся топливо, а также продукты сгорания, вода и углекислый газ практически не светятся. В самом верху наибольшая концентрация кислорода. Там не догоревшие частицы, которые в центре светились, догорают. Именно по этой причине эта зона практически не светится, хотя там наиболее высокий температурный показатель.
Читать также: Велосипед с мотором от бензопилы своими руками
Правильное разжигание костра
Чтобы костер быстро разгорелся, причем даже с одной спички, и не потух к всеобщему разочарованию, его нужно правильно разжигать.
Для этого нужно придерживаться следующего алгоритма:
- Поджигается трут, а от него — растопка. Этап с поджиганием трута можно обойти, если есть возможность получить открытый огонь, от которого поджечь непосредственно растопку.
- На горящую растопку укладывается самый тонкий хворост или щепки. В результате получается маленький неустойчивый костер, который может легко погаснуть, поэтому к этому этапу нужно подойти со всей ответственностью.
- По мере прогорания тонкого хвороста в костер добавляется хворост потолще, пока не образуются угли, толщиной в указательный палец. Только после этого костер можно считать устойчивым, поскольку его уже не задует ветром, а потухшие угли его можно будет раздуть.
Когда в огромном костре разгорятся толстые поленья, в него можно кидать даже самые сырые дрова: они сгорят без риска для костра.
В видео показан такой устойчивый костер в зимнем лесу:
Это принцип разжигания стартового костра. Стартовый костер после может быть трансформирован в другой тип, более подходящий под условия и цели. Например, «пионерский» костер с успехом трансформируется в костер «звездный», который является более экономным и позволяет приготовить еду или вскипятить воду с наименьшим расходом дров.
Классификация пламени
Классифицируют свечение огня следующим образом.
- По восприятию визуальному: цветные, прозрачные, коптящие.
- По высоте: короткие и длинные.
- По скорости распространения: быстрые и медленные.
- По температурному показателю: высокотемпературные, низкотемпературные, холодные.
- По характеру перемещения среды реакционной: пульсирующие, турбулентные, ламинарные.
- По состоянию горючей среды: предварительно перемешанные и диффузионные.
- По излучению: бесцветные, окрашенные, светящиеся.
- По агрегатному состоянию горючих веществ: пламя аэродисперсных и твёрдых реагентов, жидких и газообразных.
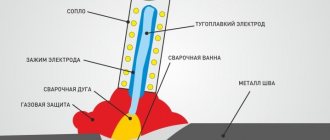
В диффузном ламинарном пламени выделяют три оболочки (зоны). Внутри конуса пламени существует:
- зона тёмная, где нет горения из-за малого количества окислителя — 300−350 градусов;
- зона светящаяся, где осуществляется термическое разложение горючего и оно сгорает частично — 500−800 градусов;
- зона слегка светящаяся, где окончательно сгорают продукты разложения горючего и достигается максимальный температурный показатель в 900−1500 градусов.
Температурный параметр пламени зависит от интенсивности подвода окислителя и природы горючего вещества. Пламя распространяется по предварительно перемешанной среде. Происходит распространение по нормали от каждой точки фронта к поверхности пламени.
По реально существующим смесям газовоздушным распространение всегда осложнено возмущающими внешними воздействиями, которые обусловлены трением, конвективными потоками, силами тяжести и прочими факторами.
Именно из-за этого реальная скорость распространения от нормальной всегда отличается. В зависимости от того, какой характер носит скорость распространения, различают такие диапазоны:
- При горении детонационном — более 1000 метров в секунду.
- При взрывном — 300−1000.
- При дефлаграционном — до 100.
Приготовление пищи на огне
Существует много разных способов приготовления пищи на костре. Мы рассмотрим лишь некоторые из них.
Шашлык
Это простой вариант готовки продуктов, позволяющий термически обработать пищу при отсутствии специальной посуды.
Для этого способа на тонкие зеленые веточки, заостренные с одной стороны, надеваются небольшие кусочки мяса. Веточки вместе с мясом располагаются над горящими углями и убираются после приготовления. Желательно во время готовки мясо на импровизированных шампурах хоть изредка переворачивать либо располагать между нагретых углей, чтобы дать ему возможность прожариться со всех сторон.
Ветки для шампуров следует срезать с неядовитого растения. Куски мяса не должны быть большие, чтобы прожариться на всю глубину.
Запекание в углях
Это еще один способ, позволяющий обойтись без дополнительной посуды. Таким образом удобнее всего готовить клубни и корни различных растений, например, клубни топинамбура или корни рогоза.
Для запекания сорванные клубни и корни кладутся в тлеющие угли и достаются через некоторое время. Запекание превращает крахмал, содержащийся в этих растениях, в более усвояемую человеческим организмом форму, а значит делает продукт более питательным.
Запекать можно не только растительную пищу, но и мясо, однако для этого потребуется фольга или листья съедобных растений, в которые и будет завернут продукт.
Классический пример запекания картошки в углях показан на видео:
Один из самых древних способов приготовления мяса выглядел так: разжигался костер и в него без предварительной обработки кидался труп животного. Мясо при такой готовке по понятным причинам жарилось неравномерно: частично оставалось сырым, а частично и вовсе сгорало. Но, несмотря на низкое качество готового продукта, оно усваивалось лучше, чем сырое.
Жарка
Жарить пищу в условиях выживания за неимением ни сковороды, ни другой специальной посуды можно на раскаленных в огне камнях.
Таким образом чаще всего готовят мясные продукты, хотя можно жарить и продукты растительного происхождения.
Для этого продукт, который необходимо пожарить, разрезают на тонкие куски. Эти кусочки раскладывают по всей поверхности разогретого камня одной стороной, а потом переворачивают, чтобы продукт прожарился на всю глубину. На фото показана такая импровизированная сковорода:


При наличии сковороды или другой специализированной посуды, а также животного жира, можно жарить продукты на жиру, растапливая жир в сковороде и опуская в него продукт.
Варка
Варка — это процесс приготовления пищи в кипящей воде.
В отличии от предыдущих способов, для варки понадобится посуда, хотя при большом желании можно кипятить воду, например, в скальном углублении, опуская в него разогретые в костре камни.
Длительная варка позволяет наиболее эффективно продезинфицировать продукт, а также убрать из него часть вредных веществ. Если продукт чист, из него можно сделать суп или бульон. Если же на счет чистоты возникают сомнения, полученный отвар лучше вылить.
Сварить пищу высоко в горах сложно из-за того, что температура кипения воды при уменьшении давления воздушного столба снижается, то есть не доходит до 100 градусов Цельсия.
Варить суп из зеленой части растений можно в течение пяти минут, бросая зелень прямо в кипяток. Такая обработка способна в некоторых случаях устранить горечь, свойственную многим сырым растениям. Однако слишком длительная термообработка снизит содержание некоторых витаминов, что нежелательно.
Бульон из продуктов животного происхождения варится до получаса: только в этом случае можно в той или иной мере быть уверенным, что все патогенные микроорганизмы были уничтожены, хотя 100% гарантии ни варка, ни другие способы термообработки не дают.
Прионы — особые белки, приводящие к неизлечимому заболеванию человека, не могут быть уничтожены термообработкой. Также варка не всегда спасает от смертельно опасного трихинеллеза, которым человек заражается при употреблении мяса зараженных животных.
Кроме прочего, варка способна нейтрализовать некоторые токсины, делая продукт съедобным.
Существуют и другие способы приготовления пищи на костре, например, запекание в нагретых камнях и копчение на костровом дыму, но они, как правило более сложны в исполнении.
Химический состав и цвет пламени
У карманных зажигалок небольшой размер, это позволяет их переносить без каких-либо проблем. Довольно редко можно встретить настольную зажигалку. Ведь они из-за своих больших размеров для переноски не предназначены. Их дизайн разнообразен. Есть зажигалки каминные. Они имеют небольшую толщину и ширину, но довольно длинные.
На сегодняшний день становятся популярными рекламные зажигалки. Если в доме нет электроэнергии, то невозможно ей поджечь газовую плиту. Газ поджигает образующаяся электрическая дуга. Достоинствами этих зажигалок являются следующие качества.
- Долговечность и простота конструкции.
- Быстрое и надёжное зажигание газа.
Первая зажигалка с современным кремнём создана в Австрии в 1903 году после изобретения ферроцериевого сплава бароном Карлом Ауэром фон Вельсбахом.
Ускорилось развитие зажигалок в период Первой мировой войны. Солдаты начали применять спички для того, чтобы видеть в темноте дорогу, но их местоположение выдавала интенсивная вспышка при поджиге. Необходимость в огне без значительной вспышки способствовало развитию зажигалок.
В то время лидерами производства зажигалок «кремнёвых» были Германия и Австрия. Такое портативное устройство, которое предназначено для получения огня, находящиеся в кармане многих курильщиков, при неправильном обращении может таить в себе немало опасностей.
Зажигалка в период работы не должна вокруг себя разбрызгивать искры. Огонь должен быть стабильным и ровным. Температура огня в зажигалках карманных достигает примерно 800−1000 градусов. Свечение красного или оранжевого цвета вызвано частицами углерода, которые раскалились. Для бытовых горелок и турбозажигалок применяется в основном газ бутан, который легко сжигается, не имеет запаха и цвета. Бутан получают путём переработки при высоких температурах нефти, а также её фракций. Бутан — это легковоспламенимые углеводороды, но он абсолютно безопасен в конструкциях современных зажигалок.
Подобные зажигалки в быту очень полезны. Ими можно поджечь любой воспламеняющийся материал. В комплект турбозажигалок входит настольная подставка. Цвет пламени зависит от горючего материала и температуры горения. Пламя костра или камина в основном имеет пёстрый вид. Температура горения дерева ниже температуры горения фитиля свечи. Именно из-за этого цвет костра не жёлтый, а оранжевый.
Медь, натрий и кальций при высоких температурных показателях светятся различными цветами.
Электрическая зажигалка была изобретена в 1770 году. В ней водородная струя воспламенялась от искры машины электрофорной. Со временем бензиновые зажигалки уступили место газовым, которые более удобные. В них обязательно должна находиться батарейка — источник энергии.
Не очень давно появились зажигалки сенсорные, в которых без механического воздействия происходит зажигание газа воздействием на сенсорный датчик. Сенсорные зажигалки карманного типа. В основном, в них содержится информация рекламного типа, которая нанесена при помощи тампонной или шелкотрафаретной печати.
Чем проклинать тьму, лучше зажечь хотя бы одну маленькую свечу. Конфуций


В начале
Первые попытки понять механизм горения связаны с именами англичанина Роберта Бойля, француза Антуана Лорана Лавуазье и русского Михаила Васильевича Ломоносова. Оказалось, что при горении вещество никуда не «исчезает», как наивно полагали когда-то, а превращается в другие вещества, в основном газообразные и потому невидимые. Лавуазье в 1774 году впервые показал, что при горении из воздуха уходит примерно пятая его часть. В течение XIX века ученые подробно исследовали физические и химические процессы, сопровождающие горение. Необходимость таких работ была вызвана прежде всего пожарами и взрывами в шахтах.
Но только в последней четверти ХХ века были выявлены основные химические реакции, сопровождающие горение, и по сей день в химии пламени осталось немало темных пятен. Их исследуют самыми современными методами во многих лабораториях. У этих исследований несколько целей. С одной стороны, надо оптимизировать процессы горения в топках ТЭЦ и в цилиндрах двигателей внутреннего сгорания, предотвратить взрывное горение (детонацию) при сжатии в цилиндре автомобиля воздушно-бензиновой смеси. С другой стороны, необходимо уменьшить количество вредных веществ, образующихся в процессе горения, и одновременно — искать более эффективные средства тушения огня.
Читать также: Насадки для полировочной машинки
Существуют два вида пламени. Топливо и окислитель (чаще всего кислород) могут принудительно или самопроизвольно подводиться к зоне горения порознь и смешиваться уже в пламени. А могут смешиваться заранее — такие смеси способны гореть или даже взрываться в отсутствие воздуха, как, например, пороха, пиротехнические смеси для фейерверков, ракетные топлива. Горение может происходить как с участием кислорода, поступающего в зону горения с воздухом, так и при помощи кислорода, заключенного в веществе-окислителе. Одно из таких веществ — бертолетова соль (хлорат калия KClO3); это вещество легко отдает кислород. Сильный окислитель — азотная кислота HNO3: в чистом виде она воспламеняет многие органические вещества. Нитраты, соли азотной кислоты (например, в виде удобрения — калийной или аммиачной селитры), легко воспламеняются, если смешаны с горючими веществами. Еще один мощный окислитель, тетраоксид азота N2O4 — компонент ракетных топлив. Кислород могут заменить и такие сильные окислители, как, например, хлор, в котором горят многие вещества, или фтор. Чистый фтор — один из самых сильных окислителей, в его струе горит вода.
Цепные реакции
Основы теории горения и распространения пламени были заложены в конце 20-х годов прошлого столетия. В результате этих исследований были открыты разветвленные цепные реакции. За это открытие отечественный физикохимик Николай Николаевич Семенов и английский исследователь Сирил Хиншельвуд были в 1956 году удостоены Нобелевской премии по химии. Более простые неразветвленные цепные реакции открыл еще в 1913 году немецкий химик Макс Боденштейн на примере реакции водорода с хлором. Суммарно реакция выражается простым уравнением H2 + Cl2 = 2HCl. На самом деле она идет с участием очень активных осколков молекул — так называемых свободных радикалов. Под действием света в ультрафиолетовой и синей областях спектра или при высокой температуре молекулы хлора распадаются на атомы, которые и начинают длинную (иногда до миллиона звеньев) цепочку превращений; каждое из этих превращений называется элементарной реакцией:
Cl + H2 → HCl + H, H + Cl2 → HCl + Cl и т. д.
На каждой стадии (звене реакции) происходит исчезновение одного активного центра (атома водорода или хлора) и одновременно появляется новый активный центр, продолжающий цепь. Цепи обрываются, когда встречаются две активные частицы, например Cl + Cl → Cl2. Каждая цепь распространяется очень быстро, поэтому, если генерировать «первоначальные» активные частицы с высокой скоростью, реакция пойдет так быстро, что может привести к взрыву.
Н. Н. Семенов и Хиншельвуд обнаружили, что реакции горения паров фосфора и водорода идут иначе: малейшая искра или открытое пламя могут вызвать взрыв даже при комнатной температуре. Эти реакции — разветвленно-цепные: активные частицы в ходе реакции «размножаются», то есть при исчезновении одной активной частицы появляются две или три. Например, в смеси водорода и кислорода, которая может спокойно храниться сотни лет, если нет внешних воздействий, появление по той или иной причине активных атомов водорода запускает такой процесс:
Таким образом, за ничтожный промежуток времени одна активная частица (атом H) превращается в три (атом водорода и два гидроксильных радикала OH), которые запускают уже три цепи вместо одной. В результате число цепей лавинообразно растет, что моментально приводит к взрыву смеси водорода и кислорода, поскольку в этой реакции выделяется много тепловой энергии. Атомы кислорода присутствуют в пламени и при горении других веществ. Их можно обнаружить, если направить струю сжатого воздуха поперек верхней части пламени горелки. При этом в воздухе обнаружится характерный запах озона — это атомы кислорода «прилипли» к молекулам кислорода с образованием молекул озона: О + О2 = О3, которые и были вынесены из пламени холодным воздухом.


Возможность взрыва смеси кислорода (или воздуха) со многими горючими газами — водородом, угарным газом, метаном, ацетиленом — зависит от условий, в основном от температуры, состава и давления смеси. Так, если в результате утечки бытового газа на кухне (он состоит в основном из метана) его содержание в воздухе превысит 5%, то смесь взорвется от пламени спички или зажигалки и даже от маленькой искры, проскочившей в выключателе при зажигании света. Взрыва не будет, если цепи обрываются быстрее, чем успевают разветвляться. Именно поэтому была безопасной лампа для шахтеров, которую английский химик Хэмфри Дэви разработал в 1816 году, ничего не зная о химии пламени. В этой лампе открытый огонь был отгорожен от внешней атмосферы (которая могла оказаться взрывоопасной) частой металлической сеткой. На поверхности металла активные частицы эффективно исчезают, превращаясь в стабильные молекулы, и потому не могут проникнуть во внешнюю среду.
Полный механизм разветвленно-цепных реакций очень сложен и может включать более сотни элементарных реакций. К разветвленно-цепным относятся многие реакции окисления и горения неорганических и органических соединений. Таковой же будет и реакция деления ядер тяжелых элементов, например плутония или урана, под воздействием нейтронов, которые выступают аналогами активных частиц в химических реакциях. Проникая в ядро тяжелого элемента, нейтроны вызывают его деление, что сопровождается выделением очень большой энергии; одновременно из ядра вылетают новые нейтроны, которые вызывают деление соседних ядер. Химические и ядерные разветвленно-цепные процессы описываются сходными математическими моделями.
Что надо для начала
Чтобы началось горение, нужно выполнить ряд условий. Прежде всего, температура горючего вещества должна превышать некое предельное значение, которое называется температурой воспламенения. Знаменитый роман Рэя Брэдбери «451 градус по Фаренгейту» назван так потому, что примерно при этой температуре (233°C) загорается бумага. Это «температура воспламенения», выше которой твердое топливо выделяет горючие пары или газообразные продукты разложения в количестве, достаточном для их устойчивого горения. Примерно такая же температура воспламенения и у сухой сосновой древесины.
Температура пламени зависит от природы горючего вещества и от условий горения. Так, температура в пламени метана на воздухе достигает 1900°C, а при горении в кислороде — 2700°C. Еще более горячее пламя дают при сгорании в чистом кислороде водород (2800°C) и ацетилен (3000°C). Недаром пламя ацетиленовой горелки легко режет почти любой металл. Самую же высокую температуру, около 5000°C (она зафиксирована в Книге рекордов Гиннесса), дает при сгорании в кислороде легкокипящая жидкость — субнитрид углерода С4N2 (это вещество имеет строение дицианоацетилена NC–C=C–CN). А по некоторым сведениям, при горении его в атмосфере озона температура может доходить до 5700°C. Если же эту жидкость поджечь на воздухе, она сгорит красным коптящим пламенем с зелено-фиолетовой каймой. С другой стороны, известны и холодные пламена. Так, например, горят при низких давлениях пары фосфора. Сравнительно холодное пламя получается и при окислении в определенных условиях сероуглерода и легких углеводородов; например, пропан дает холодное пламя при пониженном давлении и температуре от 260–320°C.
Читать также: Мотоблок заводится и глохнет в чем причина
Только в последней четверти ХХ века стал проясняться механизм процессов, происходящих в пламени многих горючих веществ. Механизм этот очень сложен. Исходные молекулы обычно слишком велики, чтобы, реагируя с кислородом, непосредственно превратиться в продукты реакции. Так, например, горение октана, одного из компонентов бензина, выражается уравнением 2С8Н18 + 25О2 = 16СО2 + 18Н2О. Однако все 8 атомов углерода и 18 атомов водорода в молекуле октана никак не могут одновременно соединиться с 50 атомами кислорода: для этого должно разорваться множество химических связей и образоваться множество новых. Реакция горения происходит многостадийно — так, чтобы на каждой стадии разрывалось и образовывалось лишь небольшое число химических связей, и процесс состоит из множества последовательно протекающих элементарных реакций, совокупность которых и представляется наблюдателю как пламя. Изучать элементарные реакции сложно прежде всего потому, что концентрации реакционно-способных промежуточных частиц в пламени крайне малы.
Внутри пламени
Оптическое зондирование разных участков пламени с помощью лазеров позволило установить качественный и количественный состав присутствующих там активных частиц — осколков молекул горючего вещества. Оказалось, что даже в простой с виду реакции горения водорода в кислороде 2Н2 + О2 = 2Н2О происходит более 20 элементарных реакций с участием молекул О2, Н2, О3, Н2О2, Н2О, активных частиц Н, О, ОН, НО2. Вот, например, что написал об этой реакции английский химик Кеннет Бэйли в 1937 году: «Уравнение реакции соединения водорода с кислородом — первое уравнение, с которым знакомится большинство начинающих изучать химию. Реакция эта кажется им очень простой. Но даже профессиональные химики бывают несколько поражены, увидев книгу в сотню страниц под названием «Реакция кислорода с водородом», опубликованную Хиншельвудом и Уильямсоном в 1934 году». К этому можно добавить, что в 1948 году была опубликована значительно большая по объему монография А. Б. Налбандяна и В. В. Воеводского под названием «Механизм окисления и горения водорода».
Современные методы исследования позволили изучить отдельные стадии подобных процессов, измерить скорость, с которой различные активные частицы реагируют друг с другом и со стабильными молекулами при разных температурах. Зная механизм отдельных стадий процесса, можно «собрать» и весь процесс, то есть смоделировать пламя. Сложность такого моделирования заключается не только в изучении всего комплекса элементарных химических реакций, но и в необходимости учитывать процессы диффузии частиц, теплопереноса и конвекционных потоков в пламени (именно последние устраивают завораживающую игру языков горящего костра).
Откуда все берется
Основное топливо современной промышленности — углеводороды, начиная от простейшего, метана, и кончая тяжелыми углеводородами, которые содержатся в мазуте. Пламя даже простейшего углеводорода — метана может включать до ста элементарных реакций. При этом далеко не все из них изучены достаточно подробно. Когда горят тяжелые углеводороды, например те, что содержатся в парафине, их молекулы не могут достичь зоны горения, оставаясь целыми. Еще на подходе к пламени они из-за высокой температуры расщепляются на осколки. При этом от молекул обычно отщепляются группы, содержащие два атома углерода, например С8Н18 → С2Н5 + С6Н13. Активные частицы с нечетным числом атомов углерода могут отщеплять атомы водорода, образуя соединения с двойными С=С и тройными С≡С связями. Было обнаружено, что в пламени такие соединения могут вступать в реакции, которые не были ранее известны химикам, поскольку вне пламени они не идут, например С2Н2 + О → СН2 + СО, СН2 + О2 → СО2 + Н + Н.
Постепенная потеря водорода исходными молекулами приводит к увеличению в них доли углерода, пока не образуются частицы С2Н2, С2Н, С2. Зона сине-голубого пламени обусловлена свечением в этой зоне возбужденных частиц С2 и СН. Если доступ кислорода в зону горения ограничен, то эти частицы не окисляются, а собираются в агрегаты — полимеризуются по схеме С2Н + С2Н2 → С4Н2 + Н, С2Н + С4Н2 → С6Н2 + Н и т. д.
В результате образуются частицы сажи, состоящие почти исключительно из атомов углерода. Они имеют форму крошечных шариков диаметром до 0,1 микрометра, которые содержат примерно миллион атомов углерода. Такие частицы при высокой температуре дают хорошо светящееся пламя желтого цвета. В верхней части пламени свечи эти частицы сгорают, поэтому свеча не дымит. Если же происходит дальнейшее слипание этих аэрозольных частиц, то образуются более крупные частицы сажи. В результате пламя (например, горящей резины) дает черный дым. Такой дым появляется, если в исходном топливе повышена доля углерода относительно водорода. Примером могут служить скипидар — смесь углеводородов состава С10Н16 (CnH2n–4), бензол С6Н6 (CnH2n–6), другие горючие жидкости с недостатком водорода — все они при горении коптят. Коптящее и ярко светящее пламя дает горящий на воздухе ацетилен С2Н2 (CnH2n–2); когда-то такое пламя использовали в ацетиленовых фонарях, установленных на велосипедах и автомобилях, в шахтерских лампах. И наоборот: углеводороды с высоким содержанием водорода — метан СН4, этан С2Н6, пропан С3Н8, бутан С4Н10 (общая формула CnH2n+2) — горят при достаточном доступе воздуха почти бесцветным пламенем. Смесь пропана и бутана в виде жидкости под небольшим давлением находится в зажигалках, а также в баллонах, которые используют дачники и туристы; такие же баллоны установлены в автомобилях, работающих на газе. Сравнительно недавно было обнаружено, что в копоти часто присутствуют шарообразные молекулы, состоящие из 60 атомов углерода; их назвали фуллеренами, а открытие этой новой формы углерода было ознаменовано присуждением в 1996 году Нобелевской премии по химии.
Описание процесса горения
Горение – это химическая реакция, при которой крупные молекулы разбиваются на более мелкие, более быстрые молекулы, посредством перестановки связей между атомами. В результате реакции выделяется энергия в виде тепла и света. Пламя – видимый процесс горения воздуха. Огонь появляется в следствии окислительно-восстановительной реакции. Чтобы данная реакция произошла, необходимо наличие 3 основных компонентов:
- топливо: твердое, жидкое, газообразное (древесина, уголь, нефть, газ и другие);
- окислитель: кислород;
- активатор: триггер для старта процесса, например, искра, солнце, спички и тд.


Горение древесины
Коротко о главном
Подводя итоги можно понять, чтобы добиться максимальной теплоотдачи от сжигаемых дров, необходимо:
- Подбирать древесину с наибольшей плотностью.
- Подготавливать дрова заранее, занимаясь распиловкой стволов и разрубкой поленьев.
- Понижать влажность в древесине, выдерживая её в штабелях под навесом в течение минимум одного года.
- При сжигании в печи обеспечить к огню приток кислорода в необходимом количестве, стараясь не превышать требуемый порог.
Где не получится развести костер
Как уже было сказано, для горения огня нужны три элемента — топливо, температура и кислород. Существуют регионы, в которых топливо найти проблематично, а значит и с костром могут быть проблемы. Приведем в пример несколько таких мест:
- Высокогорье, где кроме скальной породы и снега ничего не встретишь;
- Песчаная пустыня — еще одно место, где разжечь костер будет сложно из-за отсутствия растительности, пригодной в качестве топлива для костра. Хотя среди пустынь бывают и исключения;
- Степная зона, бедная на древесную растительность. Здесь в качестве топлива придется использовать сухую траву либо искать редкие сухие деревья.


В таком месте сложно получить устойчивый и достаточно автономный костер.
Потерпевшим кораблекрушение на океанических атоллах или скальных островах тоже не приходится задумываться о кострах, поскольку жечь здесь можно только снаряжение.
В различных помещениях (заброшенные здания, пещеры, самодельные плохопроветриваемые укрытия из легковоспламеняющихся материалов и тому подобное) хоть и есть возможность разжигать костер, но все же зачастую этого не стоит делать, поскольку можно отравиться продуктами горения или спровоцировать пожар. По тем же причинам не стоит практиковаться в разведении огня в собственной квартире или на балконе.
Однажды мы спустились в катакомбы, чтобы зарисовать карту ходов. И вот, пока я замерял расстояния и азимуты, одному из участников подземного похода захотелось разжечь костер из лежащих на проходе веток. В результате пришлось скоропостижно свернуть работу: дым заполнил ближайшие ходы, и находиться в подземелье стало невыносимо, не говоря уже про попытки составления плана. Из последующей беседы с ним выяснилось, что он, разжигая костер, предполагал, что весь дым вытянет сквозняком, чего на практике не произошло.
Исходя из вышесказанного, становится понятно, что умение обходиться без костра — вовсе не лишний навык.
Далее рассмотрим, как действовать в ситуациях, когда костер не получается разжечь по тем или иным причинам.
Альтернативы костру
Конечно невозможно заменить костер чем-то одним, что в полной мере выполняло бы его функции, не требуя наличия топлива. Однако это вовсе не означает, что без костра невозможно обойтись: совокупность разного снаряжения, приемов и материалов может в полной мере заменить костер, в некоторых случаях даже превосходя его по эффективности.
Так, например, для приготовления пищи можно использовать горелки, чем пользуются туристы, отправляющиеся в горные походы. У горелок, конечно, есть свои недостатки, но по сравнению с костром они не дымят, компактны и безопаснее в плане пожара.
В районе тропиков и экватора пищу можно готовить на раскаленных солнцем камнях или песке, а можно просто брать в поход продукты, не требующие термообработки.
Уже несколько походов мы провели на «сырой» пище вовсе без костров и горелок. Такая практика показала, что этот вариант вполне приемлем, особенно для походов в теплое время года.
Для обогрева при отсутствии костра можно использовать специальные грелки в сочетании с теплыми вещами и спальником, а в самых экстремальных случаях при отсутствии какого-либо снаряжения — кучу гниющей травы: при гниении выделяется тепло, и температура такой кучи может быть даже выше температуры тела человека.
Для сушки промокших вещей хорошо зарекомендовали себя веревки, натянутые между деревьями, а также ветви самих деревьев и кустов, на которые удобно весить все, что нужно просушить. В теплую сухую погоду вещи можно сушить прямо на ходу, подцепив их на рюкзак. В крайнем случае одежду можно сушить прямо на теле, но это допустимо только в тех случаях, если человеку не угрожает переохлаждение.
Для освещения лучше всего подходят фонари. По сравнению с костром их проще переносить, можно регулировать яркость, включать и выключать в тот момент, когда это необходимо, использовать в палатке. Фонари более безопасны и удобны в обращении.
Но если не предстоит погружение под землю, путешествие в пещеру или ночной переход по лесистой местности, при отсутствии костра и фонарика можно обойтись и естественным освещением, создаваемым звездами и Луной.
Даже в безлунную, но ясную ночь света звезд достаточно, чтобы двигаться по открытой местности, доказательством чего послужил наш поход по Олешковским пескам, в котором вместо компаса и GPS-навигатора мы шли в ночное время суток, ориентируясь по звездам.
От кровососущих насекомых спасет специальная одежда и репелленты. Из своего опыта могу сказать, что эти средства защиты значительно превосходят по своей эффективности дым от костра, кроме того, они менее вредны для организма человека и действуют везде, куда бы ни пошел человек.
Если обработать кожу хорошим репеллентом так, как показано на фото, комары не будут кусать 2-3 часа:


Как видим, несмотря на универсальность костра, как средства для выживания, в некоторых ситуациях все же можно обойтись без него, при этом не особо напрягаясь от возникших неудобств.
Например, в летнем походе выходного дня можно вполне обходиться без костров, экономя время на сбор дров, подготовку костровища, поджигание огня, приготовление еды и тушение головней, а также нервы и финансовые средства от возможного визита лесников. В то же время в аварийной ситуации, произошедшей в зимнем лесу при отсутствии спальника, вряд ли удастся обойтись без костра: продаваемые в специализированных магазинах грелки в этом случае будут малоэффективны, если даже окажутся в кармане у пострадавшего, и лишь грамотно организованный костер в этом случае даст надежду на спасение.
Автор: Максим Чечетов