Электрохимическая коррозия металлов – одна из насущных проблем человечества с того момента, как в производстве различных, необходимых человеку предметов, стали использоваться изделия из металла. Проблема защиты металлов от коррозии всегда стояла остро, потому что под действием разрушительных процессов окисления предметы теряли функциональность, деформировались и приходили в негодность, и нужно было искать способы их защиты.
Когда химия выделилась в отдельную науку, а использование металлов стало приобретать широкое промышленное значение, человечество начало исследовать эти процессы и искать способы борьбы с разрушениями от внешних воздействий.
Что такое коррозия
Процесс разрушения верхнего слоя металлического материала под влиянием внешних воздействий называется коррозией в широком смысле.

Термин коррозия в данном случае – только характеристика того, что металлическая поверхность вступает в химическую реакцию и теряет под её влиянием свои изначальные свойства.
4 основных признака, по которым можно определить, что этот процесс существует:
- процесс, развивающийся на поверхности, и со временем проникающий внутрь металлического изделия;
- реакция возникает самопроизвольно от того, что нарушается устойчивость термодинамического баланса между окружающей средой и системой атомов в сплаве или монолите;
- химия воспринимает этот процесс не просто, как реакцию разрушения, но как реакцию восстановления и окисления: при вступлении в реакцию одни атомы замещают другие;
- свойства и особенности метала при такой реакции претерпевают значительные изменения, или утрачиваются там, где она происходит.
Классификация коррозионных процессов по условиям протекания коррозии.
- Газовая коррозия протекает в газовой фазе с минимальным количеством влаги. Данная коррозия возникает при контакте металлов с агрессивными газами (галогены, кислород, оксид серы).
- Атмосферная коррозия протекает в атмосфере воздуха или другого влажного газа.
- Жидкостная коррозия – это коррозия, протекающая в различные рода жидкостях.
- Подземная коррозия – это коррозия металла, возникающая в следствии неоднородностей почвы, грунта.
- Коррозия в условиях криптоклимота происходит в условиях замкнутого пространства.
- Радиационная коррозия вызвана действием радиационного излучения.
- Морская коррозия возникает из-за депассивирующего свойства ионов хлора.
- Структурная коррозия связанна со структурной неоднородностью металлов.
- Коррозия, возникающая под действием блуждающих токов.
Виды коррозии
В зависимости от типа металла и окислительно-восстановительной реакции, происходящей с ним, коррозия может быть:
- равномерной или неравномерной;
- местной и точечной (отдельные участки почему-либо вступили в реакцию, а другие – нет);
- язвенной, известной еще как питтинг;
- подповерхностной;
- растрескивающейся;
- межкристаллической, возникающая вдоль границ кристалла металла.
Также в зависимости от того, какие именно внешние факторы воздействуют на поверхность, коррозия бывает химической и электрохимической. Химическая коррозия происходит в результате некоторых реакций под влиянием химических взаимодействий, но без участия электрического тока, и может быть присуща даже нефти и газу. Электрохимическая отличается определенными процессами, она более сложная, чем химическая.


На видео: коррозия металлов.
Основные объекты коррозии
Неоднородные металлические участки хаотично расположены на поверхности изделия и зависят от технологии и качества их изготовления, поэтому коррозионные разрушения чаще носят локальный характер. Кроме этого, локальность корродирования зависит от неоднородности:
- защитных оксидных пленок;
- электролита;
- влияния внешних факторов (нагрева, облучения);
- внутренних напряжений, вызывающих неравномерную деформацию.
Сварные и заклепочные соединения являются яркими представителями контакта инородных металлов, подвергающихся активной электрохимической коррозии. Сварка и заклепка — самые распространенные технологии в конструкции неразъемных соединений во всех ведущих отраслях промышленности и крупных трубопроводных системах:
- машиностроение;
- судостроение;
- нефтепроводы;
- газопроводы;
- водопроводы.
Наиболее значительные разрушения сварных швов и заклепочных соединений возникают в морской воде, присутствие соли в которой, значительно ускоряет процесс коррозии.
Катастрофическая ситуация сложилась в 1967 году с рудовозом «Анатина», когда морская вода от высоких штормовых волн попала в трюмы корабля. Медные конструкции во внутренней отделке трюмов и стальной корпус способствовали созданию коррозионного элемента в электролите из морской воды. Скоротечная электрохимическая коррозия вызвала размягчение корпуса судна и создание аварийной ситуации, вплоть до эвакуации команды.
Положительный эффект от электрохимической коррозии встречается очень редко. Например, при монтаже новых труб в системах горячего отопления жилых домов. Резьбовые соединения муфт начинают течь при первичном пуске до тех пор, пока продукты коррозии, состоящие из гидратированного железа, не заполнят микропоры в резьбе.
Вне зависимости от вида коррозии, химической или электрохимической, ее последствия одинаковые — разрушение изделий огромной стоимости. Причем помимо прямых потерь от пришедших в негодность материалов, существуют косвенные потери, связанные с утечками продуктов, простоями при замене негодных материалов и деталей, нарушении регламентов технологических процессов.
Причины и признаки электрохимической коррозии
Электрохимическая коррозия отличается от химической тем, что процесс разрушения проходит в системе электролитов, отчего внутри этой системы возникает электрический ток. Два сопряжённых процесса, анодный и катодный, приводят к удалению из кристаллической решетки металла неустойчивых атомов. Ионы при анодном переходят в раствор, а электроны от анодного процесса попадают в ловушку к веществу-окислителю и связываются деполяризатором.
Таким образом, деполяризация – это отвод с катодных участков свободных электронов, а деполяризатор – вещество, которое отвечает за этот процесс. Основные реакции происходят с участием водорода и кислорода в роли деполяризаторов.


Существует множество примеров электрохимической коррозии разного типа, которая оказывает воздействие на металлические поверхности в природе и проходит под влиянием различных условий. Водород при этом работает в кислой среде, а кислород – в нейтральной.
Практически все металлы подвергаются электрохимической коррозии, и по этому признаку их разбивают на 4 группы, определяют величину их электродного потенциала:
- активные коррозируют даже в той среде, где нет окислителей;
- среднеактивные вступают в реакцию окисления в кислотной среде;
- малоактивные не вступают в реакцию при отсутствии окислителей и в нейтральных, и в кислых средах;
- не вступают в реакцию — высокой стабильности (благородные металлы, палладий, золото, платина, иридий).
Самый распространенный вид электрохимической коррозии – атмосферная.


Но эта же реакция может протекать и в воде, в растворах оснований, солей и кислот. В узкоспециальном различии атмосферной коррозии различают почвенную и аэрационную, морскую и биологическую (протекающую под воздействием бактерий).
Есть даже электрическая коррозия, которая протекает под воздействием электрического тока, и является результатом работы блуждающих токов, возникающих там, где электрический ток используется человеком для осуществления определенной деятельности.
Гомогенная металлическая поверхность при этом разрушается из-за термодинамической неустойчивости к окружающей среде. А гетерогенная – из-за состава кристаллической решётки, в которой атомы одного металла держатся плотнее, чем атомы инородных вкраплений. Эти реакции отличаются скоростью протекания ионизации ионов, и восстановления окислительных компонентов окружающей среды.
Разрушение металлических поверхностей при электрохимической коррозии состоит в одновременном протекании двух процессов: анодного и катодного, и отличия процессов состоят в том, что растворение происходит на анодах, которые и контактируют с окружающей средой через множество микроэлектродов, которые входят в состав поверхности любого металла и замкнуты на себя.
Характерными примерами электрохимической коррозии можно считать протекание коррозионных процессов на днищах морских судов или в атмосфере на металлических конструкциях.


Основные разновидности
При коррозии в электролитах происходит преобразование химической энергии в электрическую. В связи с этим ее называют электрохимической. Принято различать следующие виды электрохимической коррозии.
Межкристаллитная
Под межкристаллитной коррозией подразумевается такое опасное явление, при котором происходит разрушение границ зерна никеля, алюминия и других металлов избирательным образом. Как следствие, прочностные и пластичные свойства материала утрачиваются. Главная опасность этой разновидности коррозии в том, что далеко не всегда она заметна визуально.


Питтинговая
Питтинговая электрохимическая коррозия представляет собой точечное поражение отдельных участков поверхности меди и других металлов. В зависимости от характера поражения, различают закрытый, открытый, а также поверхностный питтинг. Размеры пораженных участков могут варьироваться от 0,1 мм до 1,5 мм.


Щелевая
Щелевой электрохимической коррозией принято называть усиленный процесс разрушения металлических конструкций в местах расположения щелей, зазоров и трещин. Протекание щелевой коррозии может происходить в воздушной атмосфере, газовых смесях, а также морской воде. Данный вид разрушения характерен для газопроводов, днищ морских судов и многих других объектов.
Распространено протекание коррозии в условиях небольшого количества окислителя из-за затрудненного подхода к стенкам щели. Это приводит к накоплению коррозийных продуктов внутри зазоров. Электролит, содержащийся во внутреннем пространстве зазора, может изменяться под воздействием гидролиза продуктов коррозии.


С целью защиты металлов от щелевой коррозии принято применять несколько методов:
- уплотнение зазоров и щелей;
- электрохимическая защита;
- процесс ингибирования.
В качестве профилактических методов следует использовать только те материалы, которые в наименьшей степени подвержены возникновению ржавчины, а также изначально грамотно и рационально конструировать газопроводы и другие важные объекты.
Грамотная профилактика во многих случаях представляет собой более простой процесс, чем последующая очистка металлоконструкций от въевшейся ржавчины.
Необходимость антикоррозионной защиты
Защита металла от воздействий, которые разрушающе действуют на его поверхность – одна из основных задач, возникающих перед теми людьми, которые работают с механизмами, агрегатами и машинами, морскими судами и строительными процессами.
Любой металл, кроме благородных, в той или иной степени, подвергается воздействию разрушительных процессов.


Чем активнее эксплуатируется устройство или деталь, тем больше шансов у нее подвергнуться разрушительному воздействию и атмосферных условий, жидкостей, с которыми приходится сталкиваться в процессе работы. Над защитой металла от коррозии работают многие отрасли науки и промышленного производства, но основные способы остаются при этом неизменными, и состоят в создании защитных покрытий:
- металлических;
- неметаллических;
- химических.
Неметаллические покрытия создаются с помощью органических и неорганических соединений, их принцип действия достаточно эффективен и отличается от остальных типов защиты. Для создания неметаллической защиты в промышленном и строительном производстве используются лакокрасочные составы, бетон и битум и высокомолекулярные соединения, особенно активно взятые на вооружение в последние годы, когда больших высот достигла химия полимеров.


Химия внесла свой вклад в создание защитных покрытий методами:
- оксидирования (создания защитной пленки на металле с помощью оксидных пленок);
- фосфатирования (фосфатных пленок);
- азотирования (насыщения поверхности стали азотом);
- цементации (соединения с углеродом);
- воронения (соединения с органическими веществами);
- изменения состава металла путем введения в него антикоррозийных добавок);
- модификации окружающей коррозийной среды путем введения ингибиторов, влияющих на нее.
Электрохимическая защита от коррозии – это процесс, обратный электрохимической коррозии. В зависимости от смещения потенциала металла в положительную или отрицательную стороны, различают анодную и катодную защиту. Путем подсоединения к металлическому изделию протектора или источника постоянного тока на металлической поверхности создается катодная поляризация, которая и препятствует разрушению металла через анод.
Электрохимические методы защиты состоят в двух вариантах:
- металлическое покрытие защищено другим металлом, у которого более отрицательный потенциал (то есть, защищающий металл менее устойчив, чем защищаемый), и это называется анодное покрытие;
- покрытие нанесено из менее активного металла, и тогда он является и называется катодным.


Анодная защита от коррозии – это, например, оцинкованное железо. Пока не израсходуется весь цинк с защитного слоя, железо будет в относительной безопасности.
Защита катодным способом – это никелирование или нанесение меди. В этом случае разрушение защитного слоя приводит и к разрушению того слоя, который он защищает. Присоединение протектора для предохранения металлического изделия ничем не отличается от протекания реакции в других случаях. Протектор выступает в роли анода, а то, что находится под его протекторатом, остается в сохранности, используя созданные ему условия.
Как предотвратить появление электрохимической коррозии?
Процесс защиты начинается еще на этапе создания металлического объекта. Существуют определенные нормы эксплуатации. Они разрабатываются исходя из экономической целесообразности и безопасности. Яркий пример — цинкование. Оцинкованные металлы гораздо меньше подвержены электрохимической коррозии, однако магистральные трубопроводы из них не делают. Экономически это невыгодно, поэтому для трубопроводов разрабатываются другие методы, например изоляция.

Цинковый слой на полотенцесушителях из нержавеющей стали — одно из наиболее часто встречающихся методов сохранения целостности и защиты поверхности.
Цинковый слой на полотенцесушителях из нержавеющей стали — одно из наиболее часто встречающихся методов сохранения целостности и защиты поверхности.
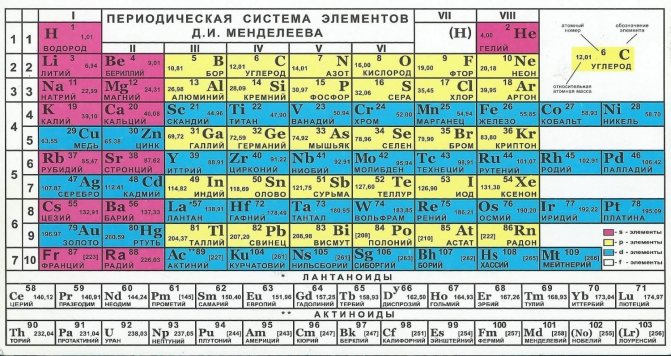
Легирование – наиболее распространенный способ повышения коррозионной устойчивости. На этапе создания сплава в его состав добавляется определенный процент металлов, с наименьшей подверженностью коррозии. К сожалению, периодическая таблица элементов не дает описания фактора устойчивости, однако некоторые закономерности прослеживаются. Наименее устойчивыми являются щелочные металлы, находящиеся в 1 и 2 группах. Однако в подгруппах, обозначенных в таблице синим цветом, прослеживается связь с атомным номером. Чем он выше, тем устойчивее металл:
- медь (29);
- цинк (30);
- серебро (47);
- кадмий (48);
- золото (79).
Также закономерность наблюдается в побочных подгруппах 4 и 6:
- титан (22);
- хром (24);
- цирконий (40);
- молибден (42).
И так далее. А наиболее устойчивые металлы находятся 8 группе (осмий, иридий, платина), но ввиду их дороговизны, в легировании сталей они используются крайне редко.
Что касается защиты готового изделия, то тут выделяется 4 типа, каждый из которых делится на несколько способов. Например, металлические покрытия разделяют на:
- диффузионные;
- гальванические;
- металлизационные.
Разнится технология нанесения защитного слоя, но объединяет их суть защиты. Металлическое изделие покрывается слоем другого металла, более устойчивого к электрохимической коррозии. Это позволяет сохранить характеристики изначальной стали, используемой при производстве изделия, но повышает уровень защиты, так как коррозия воздействует на верхний слой.
Неметаллические методы защиты также делятся на несколько категорий:
- лакокрасочные;
- оксидные;
- фосфатные;
- эмалевые;
- полимерные.
Суть этих методов в нанесении на поверхность неметаллического компонента. Они менее затратные, но уступают по качеству металлизированным видам. Любое покрытие имеет ограниченный срок службы, зато можно обновлять покрытие без существенных затрат.
Суть этих методов в нанесении на поверхность неметаллического компонента. Они менее затратные, но уступают по качеству металлизированным видам. Любое покрытие имеет ограниченный срок службы, зато можно обновлять покрытие без существенных затрат.
Помимо этого, существуют методы защиты, не связанные с самим изделием. Они заключаются в снижении агрессивности среды. Сюда можно отнести понижение уровня влажности в помещении, или добавление в среду специальных ингибиторов, то есть замедлителей процесса. С подземными сооружениями часто применяют электрическую защиту, направляя на изделие отрицательный заряд тока, тем самым превращая его в самостоятельный проводник. Это защищает изделие от блуждающих токов, но не снижает воздействия влаги.


Как защитить полотенцесушитель от воздействия «блуждающих токов»? Вот несколько реальных способов:
- И крайне важное. Доверять установку полотенцесушителя только профессионалам с определенным уровнем квалификации, подтверждающей возможность осуществлениями ими такого рода работ!
- Обязательно заземлить прибор. Это можно сделать несколькими способами. Технически для металлических труб потребуется подсоединиться к РЕ-шине электрического щита на этаже с помощью медного провода. Для металлопластиковых труб потребуется установить между шаровым краном и элементом подсоединения металлическую вставку, например, нипель — на него подсоединить провод из меди и также связать с ближайшим электрощитом. В комбинированной системе потребуется дополнительно соединить проводом разорванные металлические части стояка.
- Уровнять потенциалы в пределах комнаты. Для этого используется специальная система уравнивания и устанавливается коробка с пластиковым корпусом с заземляющей шиной. К шине с помощью медного кабеля подсоединяются все «потенциально» проводящие ток приборы. Саму шину, имеющую большее сечение, соединяют с этажным электрощитом.
- Есть выход из ситуации попроще — приобретение полотенцесушителя из цельнотянутой трубы, пример это полотенцесушитель .
- Заменить водяной полотенцесушитель на электрический. Все электрические полотенцесушители имеют небольшую мощность, поэтому включать их можно в обычную электрическую розетку. Но, так как в ванной комнате постоянно присутствует вода и бывает высокая влажность, подключение прибора должно производиться только через устройство защитного отключения (УЗО) и автоматический выключатель (автомат). Заземление здесь также обязательно!!!
Способы защиты металла
Электрохимическая коррозия – одно из основных препятствий, которые встречаются на пути человеческой деятельности. Защита от воздействия разрушительных процессов и их протекания на поверхности конструкций и сооружений – одна из перманентных и насущных задач любого промышленного производства, и любой бытовой деятельности человека.


Разработано несколько способов такой защиты, и все они активно применяются в повседневном цикле жизнедеятельности:
- Электрохимическая защита – электролитическое по принципу работы использование химических закономерностей, защищает металл с помощью анодного, катодного и протекторного принципа.
- Электроискровая обработка с использованием различных установок – бесконтактных, контактных, анодно-механических.
- Электродуговое напыление – основное преимущество в толщине наносимого слоя и относительной дешевизне производимого процесса.
- Эффективная антикоррозийная обработка – удаление загрязнений и очистка обрабатываемой поверхности, с последующим нанесением на поверхность сначала противокоррозионного, а затем и дополнительного защитного слоя.
Все эти способы наработаны в процессе деятельности человека с целью защиты инструментария, средств передвижения и транспортировки на стыке нескольких промышленных отраслей, и с использованием научных достижений.
Электрохимическая коррозия, которая является естественным процессом разрушения поверхности металла под воздействием нейтральных или агрессивных факторов окружающей среды, представляет собой сложную проблему. Убытки от нее терпят и машиностроительные, и транспортные, и промышленные предприятия, средства передвижения. И это проблема, которая требует ежедневного разрешения.
Подробнее о коррозии и ее процессах (1 видео)
Разные виды коррозии (19 фото)
Технический прогресс в развитии методов борьбы с коррозией
Так как коррозионные потери металла составляют астрономическую сумму, технический прогресс продолжает предлагать новые методы борьбы с ней, по мере развития научных исследований и совершенствования аппаратного обеспечения. К ним относятся:
- газотермическое напыление, образующее сверхтонкие защитные покрытия;
- термодиффузионные покрытия, создающие прочную поверхностную защиту;
- кадмирование, обеспечивающее защиту стали в морской воде.
Рост промышленного производства происходит с постоянным увеличением выпуска металлических изделий. Электрохимическая коррозия, вне зависимости от исторической эпохи, представляет постоянную угрозу огромному объему конструкций и ответственных сооружений. Поэтому создание новых методов и средств борьбы — одна из задач исследований технического прогресса.
Катодная защита
Реализация принципа катодной защиты может осуществляться одним из двух способов. Первый — подача отрицательного потенциала может происходить от специального источника электроэнергии, именуемого станцией катодной защиты.
При использовании катодных станций может возникнуть следующая проблема.
Электричество для установки требуемого потенциала нередко подается по длинному кабелю. Этот кабель подвержен действию молнии и некоторым другим электромагнитным влияниям. Для того, чтобы в результате не произошло перенапряжения, рекомендуется использовать комплексное решение ZANDZ.
Коррозия отдельных металлов.
Скорости годовой коррозии некоторых металлов и сплавов в различных средах приведены в таблице 2. Таблица 2 — Скорости коррозии мм/год конструкционных металлов в различных средах.
| Металл | Серная 5% | Уксусная 5% | Азотная 5% | NaOH 5% | Пресная вода | Морская вода | Городской воздух |
| Алюминий | 8-100 | 0,5-5 | 15-80 | 13000 | 0,1 | 1-50 | 0-0,5 |
| Цинк-олово | Высокая | 600-800 | Высокая | 0,5-10 | 0,5-10 | 0,5-10* | 0-0,2 |
| Свинец- железо | 2-500- | 2-500* | 100-1000 | 0-0,5 | 0-0,5 | 0,2-15 | 0-0,2 |
| Кремний- железо | 0-2 | 10-150* | 100-6000 | 0,1-2 | 0,1-2 | 0,2-15 | 0-0,2 |
| Сталь | 15-100* | 10-100 | 1000-10000 | 0,1-10* | 0,1-10* | 0,1-10* | 0,2 |
| Нержав. сталь | 0-5 | 0-0,2 | 20 | 0-0,2 | 0-0,2 | 0-3 | 0-0,2 |
| Медные сплавы | 0-100 | 0-0,5 | 0-2 | 0-0,2 | 0-0,2 | 0-200 | <0,1 |
| Никель | 2-50 | 2-15* | 150-1500 | 0-1 | 0-1 | 0,2-15* | <0,1 |
| Никелевые сплавы | 2-35* | 2-10* | 0,1-1500 | 0-1 | 0-1 | 0,2-15* | <0,1 |
| Титан | 10-100 | <0,1 | <0,1-1 | <0,2 | <0,1 | <0,1 | <0,1 |
| Молибден | 0-0,2 | <0,1 | Высокая | <0,1 | <0,1 | <0,1 | <0,1 |
| Цирконий | <0,5 | <0,1 | <0,1 | <0,1 | <0,1 | <0,1 | <0,1 |
| Тантал | <0,1 | <0,1 | Высокая | <0,1 | <0,1 | <0,1 | <0,1 |
| Серебро | 0-1 | <0,1 | <0,1 | <0,1 | <0,1 | <0,1 | — |
| Платина | <0,1 | <0,1 | <0,1 | <0,1 | <0,1 | <0,1 | — |
| Золото | <0,1 | <0,1 | <0,1 | <0,1 | <0,1 | <0,1 | — |
5.1 Коррозия железа и сталей.
Самыми распространёнными конструкционными металлами были и остаются сплавы на основе железа — стали (С < 2,14% от общей массы) и чугуны (C > 2,14% от общей массы). Железо наиболее подверженный атмосферной коррозии металл по причине выделения водорода и кислородной деполяризации. Для стали наиболее опасна питтинговая коррозия.
Коррозия железа начинает протекать при относительной влажности более 75%. Если необходимый для деполяризации кислород отсутствует, то в качестве акцептора электронов могут выступать ионы железа (III), восстанавливаясь до железа (II), которые затем взаимодействуют с кислородом и окисляются снова до железа (III).
2Fe2+ + 2H+ + 0.5O2 = 2Fe3+ + H2O
Таким образом ионы железа (III) выступают в роли переносчика кислорода, ускоряя коррозию. Реакция коррозии железа в атмосферном воздухе приведена в начале статьи.
Образование оксидной защитной плёнки на поверхности железа возможно только в присутствии сильного окислителя, например, азотная кислота. В обычных же условиях окисная пленка на железе рыхлая и пористая, т.е. не способна защитить его от коррозии.
Для защиты от коррозии сталь легируют добавлением некоторых компонентов. Их влияние можно обобщить следующим образом:
- Медь до 0,2% повышает коррозионную стойкость в атмосферных условиях.
- Фосфор до 0,1% в комбинации с медью также повышает коррозионную стойкость, но никак не защищает от питтинга.
- Хром и никель снижают скорость коррозии благодаря тому, что образуют на поверхности стали защитную плёнку. Хром в количестве 13% существенно замедляет скорость коррозии. При легировании хромом более 30% сталь становится также устойчива и к питтинговой коррозии.
- Кремний повышает стойкость против питтинговой коррозии, но увеличивает вероятность межкристаллической коррозии.
При использовании материалов на основе железа в прибрежной атмосфере следует применять катодную защиту. В промышленности, поверхность сталей следует защищать от коррозии защитными покрытиями, а также применять подходящие ингибиторы коррозии. Чаще всего в качестве защитного покрытия применяют цинк и его сплавы, кадмий, порошково-полимерные и цинкнапоолненные краски.
5.2 Коррозия алюминия и его сплавов.
Вторым по популярности конструкционным материалом являются сплавы на основе алюминия. Потенциал алюминия -1,66 В, что свидетельствует об его высокой активности и реакционноспособности. Несмотря на это, алюминий имеет большую склонность к пассивации и обладает высокой стойкостью к атмосферной коррозии. В пассивном состоянии поверхность алюминия покрыта тонкой плёнкой оксидов (байерит). Однако данная плёнка устойчива только в нейтральных средах (4,5 < pH < 8,5). В концентрированных кислотах неокислительного характера или в щелочах алюминиевые изделия подвергаются сильной коррозии.
Реакция взаимодействия алюминия с кислородом:
4Al + 3O2 = 2Al2O3
Реакция взаимодействия алюминия с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
Чистый алюминий проявляет высокую коррозионную стойкость и пластичность, но обладает низкой механической прочностью. Для повышения прочности и способности к тепловой обработке добавляют легирующие компоненты.
Добавление легирующих компонентов, потенциал которых более электроположительный чем потенциал алюминия, приводит к образованию катодных и анодных зон. Например, при добавлении в сплав меди образуется интерметаллидная фаза CuAl3. Являясь катодом по отношению к основному металлу, CuAl3 осаждается на границе зерна, из-за чего области вблизи этих границ оказываются обеднёнными медью и будут являться анодами по отношению к самим границам зёрен, вызывая межкристаллитную коррозию.
Частным случаем коррозии алюминия с участием интерметаллидов являются так называемые «черные точки». Коррозия такого типа идет в три этапа:
- появление черных точек на поверхности алюминия в зонах локальной концентрации интерметаллидов;
- чёткое проявление границ интерметаллидов,
- растворение интерметаллидов и образование несплошностей в виде глубоких питтингов и язв.
На крупногабаритных деталях этот эффект проявляется особенно сильно. Часто точки могут возникать при травлении и анодировании алюминия. Сразу после травления точки могут быть не видны, т.к. они скрыты под слоем травильного шлама. Но если деталь промыть и дать высохнуть на воздухе, то со временем шлам желтеет и черные точки становятся легко различимы невооруженным глазом (рисунок 8).


Рисунок 8 — Пример черных точек на травленом алюминии Д16.
Стандартные электродные потенциалы различных сплавов алюминия и некоторых интерметаллидов приведены в таблице 3.
Таблица 3 — Стандартные электродные потенциалы сплавов алюминия и интерметаллидов.
| Сплав или интерметаллид | Вид полуфабриката | Стационарный потенциал, мВ |
| Д16чТ | панель | -595 |
| 1973Т2 | плита | -685 |
| В95пчТ2 | прессованная полоса | -675 |
| В95пчТ3 | штамповка | -700 |
| Al2Mg3Zn3 | — | -1215 |
| CuAl2 | — | -610 |
| Al2CuMg | — | -720 |
* За стационарные потенциалы принимали потенциал, установившийся через 24 часа в 3%-м рас-творе хлорида натрия по хлорид-серебрянному электроду.
Добавление более электроотрицательных компонентов, таких как магний, увеличивает пассивацию алюминия, благодаря чему коррозионная стойкость возрастает.
Наиболее популярными покрытиями для защиты алюминия и его сплавов от коррозии являются анодирование, химическое никелирование и многослойные покрытия на основе меди, никеля, серебра и олова.
5.3 Коррозия меди и её сплавов.
Чистая металлическая медь имеет потенциал 0,337 В, благодаря чему в обычной атмосфере обладает неплохой коррозионной стойкостью. Она не разрушается под действием неокисляющих кислот или в присутствии депассиватора. Разрушение меди начинается в присутствии окисляющих кислот (азотная кислота и пр.), органических кислот, а также комплексообразователей.
Несмотря на то, что медь практически не взаимодействует с кислородом, при контакте с влажным воздухом медь начинает разрушаться. Образовавшиеся продукты коррозии нерастворимы и предотвращают дальнейшую коррозию металла.
2Cu + H2O + CO2 + O2 → CuCO3 + Cu(OH)2↓
Из-за высокой теплопроводности и неплохой коррозионной стойкости в воде медь популярна в конструкциях теплообменников или трубопроводов. Однако медь подвержена кавитационной и эрозийной коррозии. Чтобы предотвратить данную коррозию медь легируют.
В большинстве случаев легирующие элементы придают меди не только более высокую коррозионную стойкость, но и улучшают её механические свойства. Наиболее распространёнными легирующими элементами являются цинк, никель, олово, алюминий и кремний.
Сплавы меди с цинком, при содержании последнего в диапазоне от 15% до 50%, называются латунями. Латунь обладает высокой прочностью, хорошей обрабатываемостью и стойкостью к действию сульфидов. Цинк, будучи более реакционноспособным металлом по сравнению с медью, легко подвергается селективному выщелачиванию. В этом случае на поверхности латуни можно наблюдать отложения меди характерного красного цвета.
Среди прочих сплавов меди особое значение имеет сплав с оловом. Добавка олова значительно повышает предел усталости и в то же самое время позволяет сохранить коррозионную стойкость.
5.4 Коррозия других металлов.
Титан
является катодным металлом по отношению большинству прочих металлов и сплавов. На нём легко образуется оксидная плёнка, устойчивая к действию большинства кислот, в том числе соляной. Благодаря сочетанию своих свойств: высокой прочности, низкому удельному весу, высокой коррозионной стойкости, стойкости к высокотемпературному окислению и высокой точке плавления, титан получил применение в самолётостроении.
Никель
обладает рядом физических и механических свойств сравнимых с малоуглеродистой сталью. В то же самое время никель обладает более высокой коррозионной стойкостью. В качестве легирующего элемента никель повышает коррозионную стойкость таких металлов, как железо и медь. Чистый никель почти не подвержен контактной коррозии, поскольку благодаря образованию защитной оксидной плёнки является катодом по отношению к большинству металлов. Оксидная плёнка никеля устойчива к действию щелочей.
Кобальт
во многих отношениях схож с никелем. В сочетании с хромом кобальт образует сплавы, обладающие превосходной стойкостью к высокотемпературному окислению. Подобно никелю кобальт может быть легко запассивирован, особенно при добавлении в него хрома.
Свинец
демонстрирует высокую коррозионную стойкость к серной кислоте. Свинцом покрывают ёмкости и трубы, находящиеся в контакте с этой кислотой. Добавление 3-6% сурьмы повышает механическую прочность свинца. Однако слишком большая доля сурьмы нежелательна, поскольку она ухудшает коррозионные свойства свинца, сурьма легко подвергается действию серной кислоты.
Цинк
и его сплавы нельзя применять в коррозионных атмосферах. Этот металл является слишком анодным и не образует практически никакой защитной плёнки.
Почти все благородные металлы демонстрируют высокую коррозионную стойкость в любых кислых и щелочных средах. Серебро и его сплавы растворяются в окисляющих кислотах, но являются устойчивыми по отношению к восстанавливающим. Золото и платина устойчивы к действию даже окисляющих кислот. Они растворимы в так называемой царской водке.