4.7
Средняя оценка: 4.7
Всего получено оценок: 117.
4.7
Средняя оценка: 4.7
Всего получено оценок: 117.
Плавлением в физике называют переход вещества из твердого состояния в жидкое. Классическими примерами процесса плавления являются таяние льда и превращение твердого куска олова в жидкий припой при нагревании паяльником. Передача телу определенного количества тепла приводит к изменению его агрегатного состояния.
Почему твердое становится жидким?
Нагревание твердого тела приводит к увеличению кинетической энергии атомов и молекул, которые при нормальной температуре находятся четко в узлах кристаллической решетки, что и позволяет телу сохранять постоянные форму и размеры. При достижении некоторых критических значений скоростей атомы и молекулы начинают покидать свои места, происходит разрыв связей, тело начинает терять свою форму — становится жидким. Процесс плавление происходит не резким скачком, а постепенно, так, что некоторое время твердая и жидкая компоненты (фазы) находятся в равновесии. Плавление относится к эндотермическим процессам, то есть к таким которые происходят с поглощением теплоты. Противоположный процесс, когда жидкость затвердевает называется кристаллизацией.
Рис. 1. Переход твердого, кристаллического, состояния вещества в жидкую фазу.
Было обнаружено, что до окончания процесса плавления температура не изменяется, хотя тепло все время поступает. Никакого противоречия здесь нет, так как поступающая энергия в этот период времени уходит на разрыв кристаллических связей решетки. После разрушения всех связей приток тепла будет повышать кинетическую энергию молекул, а следовательно, температура начнет расти.
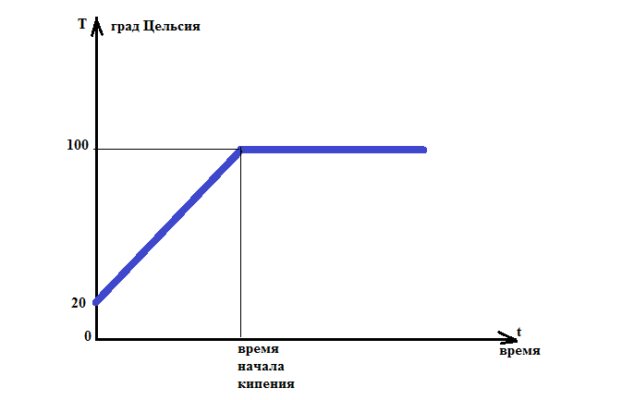
Рис. 2. График зависимости температуры тела от времени нагрева.
Родственные величины
Так называемые удельные показатели существуют для характеристики не только плавления и кристаллизации. В физической науке помимо этих процессов удельными величинами теплоты характеризуются:
- парообразование;
- конденсация;
- теплоемкость.
Удельный показатель теплоты парообразования и конденсации отображает объем теплоты, необходимый для обращения единицы массы жидкости в пар и наоборот. Формула этой величины: Q/m. Таким образом, по сути, это то же самое, что и энтальпия расплавки и кристаллизации.
Что касается удельной теплоемкости, то это показатель соотношения теплоемкости и массы вещества. Он равен объему теплоты, передача которого единичной массе вещества необходима для изменения его температуры на один градус.
Определение удельной теплоты плавления
Удельной теплотой плавления (обозначение — греческая буква “лямбда” – λ ), называется физическая величина равная количеству тепла (в джоулях), которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкую фазу. Формула удельной теплоты плавления выглядит так:
$$ λ ={Q \over m}$$
где:
m — масса плавящегося вещества;
Q — количество тепла, переданное веществу при плавлении.
Значения для разных веществ определяют экспериментально.
Зная λ, можно вычислить количество тепла, которое необходимо сообщить телу массой m для его полного расплавления:
$$Q={λ*m}$$
Общая информация
Правильное понимание удельного значения теплоты плавления невозможно без изучения ключевых особенностей самого процесса расплавки. И при плавлении, и при кристаллизации какого-либо вещества его внутренняя энергия изменяется. При первом процессе она возрастает, так как он неизменно сопровождается нагреванием — главным условием для увеличения энергии. Температура же при расплавке остается неизменной. В определенном смысле это парадоксально, ведь внутренняя энергия может характеризоваться температурой.
Однако увеличению энергии при неизменной температуре существует весьма простое и логичное объяснение. Во время процесса расплавки разрушается пространственная решетка кристаллического тела, на это уходит вся энергия. Разрушение кристаллической решетки требует расходования определенного количества энергии со стороны какого-либо внешнего источника. Как следствие, в ходе процесса расплавки происходит увеличение внутренней энергии тела.
В процессе отвердевания тела или, иначе говоря, кристаллизации, напротив, происходит уменьшение его внутренней энергии, так как оно отдает тепло телам, которые его окружают. Отвердевание (кристаллизация) — это обратный процесс по отношению к расплавке. Молекулы вещества образуют общую (единую) систему, и в ходе этого объединения отдаваемая составляющими вещества избыточная энергия поглощается внешней средой.
Основные сведения о теплоте плавления
По закону сохранения энергии тело поглощает в ходе плавления и отдает во время отвердевания (при необходимой для каждого из этих процессов температуре) равное количество тепла.
Теплотой плавления называют количество теплоты, которое необходимо для того, чтобы физическое тело при температуре плавления перешло в жидкое состояние из твердого. Это тепловое явление — частный случай фазового перехода в термодинамике.
На теплоту расплавки влияют масса плавящегося вещества, а также свойства, которыми оно обладает и которые для него характерны. Эта связь между теплотой расплавки физического тела и родом вещества, выражающаяся через зависимость первого от второго, измеряется удельной величиной.
Для плавления вещества требуется такое же количество тепла, которое выделяется при кристаллизации, поэтому определение удельного значения теплоты существует в двух равнозначных понятиях — для плавления и для кристаллизации. У этой величины есть и альтернативное наименование — энтальпия плавления.
Особенности измерения
Экспериментальным путем ученые-физики установили, что для перевода одного и того же вещества в жидкое из твердого состояния требуется разное количество теплоты. Затем исследователями-экспериментаторами было принято решение сравнить эти показатели при одинаковой массе вещества. Так появилось понятие удельной величины.
Согласно ее упрощенному определению, она показывает соотношение теплоты плавления тела из определенного вещества и его массы. Этот показатель считается главной характеристикой как для плавления, так и для кристаллизации.
Единицей измерения этой величины, согласно Международной системе единиц, считается Дж/кг (джоуль на килограмм). Обозначается удельный показатель буквой лямбда (реже встречается прочтение как ламбда) из греческого алфавита (аналог кириллической буквы «л»).
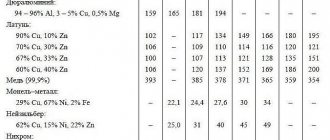
Удельная теплота плавления некоторых веществ
Информацию о значениях удельной теплоты для конкретного вещества можно найти в книжных справочниках или в электронных версиях на интернет-ресурсах. Обычно они приводятся в виде таблицы:
Удельная теплота плавления веществ
| Вещество | 105 * Дж/кг | ккал/кг | Вещество | 105 * Дж/кг | ккал/кг |
| Алюминий | 3,8 | 92 | Ртуть | 0,1 | 3,0 |
| Железо | 2,7 | 65 | Свинец | 0,3 | 6,0 |
| Лед | 3,3 | 80 | Серебро | 0,87 | 21 |
| Медь | 1,8 | 42 | Сталь | 0,8 | 20 |
| Нафталин | 1,5 | 36 | Цинк | 1,2 | 28 |
| Олово | 0,58 | 14 | Платина | 1,01 | 24,1 |
| Парафин | 1,5 | 35 | Золото | 0,66 | 15,8 |
Одним из самых тугоплавких веществ является карбид тантала — TаC. Он плавится при температуре 39900С. Покрытия из TаC применяют для защиты металлических в форм, в которых отливают детали из алюминия.


Рис. 3. Процесс плавки металла.
Особенности
Наряду с великим разнообразием известных металлов рассматриваемый элемент имеет относительно небольшую тепловую емкость при средней степени подогрева. Величина в отношении стали соответствует 440 – 550 Дж/(кг · град), чугуна – 370 – 550 Джоулей/(кг · градус), никеля – 440 Дж/(кг · град).
Отдельное внимание стоит уделить тому, что показатели тяжелых металлических компонентов не имеют высокого значения. А потому знаменитые физики выявили следующую зависимость: чем выше плотность, тем меньше коэффициент теплоты.
Тематические задания
Изучение тепловых явлений и их особенностей, к числу которых относится и удельная теплота, входит в школьную программу по физике для старших классов. Для проверки усвоения пройденного материала используются тематические задачи.
Задания на нахождение удельной теплоты парообразования помимо обычных текстовых условий в большинстве случаев сопровождаются графиками, отображающими температурные изменения, которые происходили с веществом по мере поглощения им теплоты.
Но графические задачи — не самые интересные. В число наиболее занимательных заданий входят такие:
- Кусок льда, размещавшийся в температуре -90 градусов Цельсия, начали нагревать посредством подведения к нему тепловой мощности постоянного типа. По прошествии 63 секунд от начала нагревания лед достиг температуры, необходимой для плавления. Требуется найти время в секундах, которое займет процесс плавления льда от момента его достижения нужного нагрева при условии, что потери теплоты нет. Ответ: 110 секунд.
- Кусок свинца, пребывавший в температуре +27,5 градуса Цельсия, путем подведения к нему постоянной тепловой мощности начали нагревать. Спустя 39 секунд после начала нагревания температура свинца достигла уровня плавления (+327,5 градуса Цельсия). Нужно определить продолжительность процесса плавления свинца в секундах от этого момента, с учетом отсутствия тепловых потерь. Ответ: 25 секунд.
Кипение
Кипение — это парообразование, происходящее по всему объёму жидкости.
Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. При нагревании жидкости этот воздух расширяется, пузырьки воздуха постепенно увеличиваются в размерах и становятся видимы невооружённым глазом (в кастрюле с водой они осаждают дно и стенки). Внутри воздушных пузырьков находится насыщенный пар, давление которого, как вы помните, быстро растёт с повышением температуры.
Чем крупнее становятся пузырьки, тем большая действует на них архимедова сила, и определённого момента начинается отрыв и всплытие пузырьков. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости; пар в них конденсируется, и пузырьки сжимаются опять. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар — шум сменяется бульканьем, жидкость кипит.
Пузырьки, таким образом, служат «проводниками» пара изнутри жидкости на её поверхность. При кипении наряду с обычным испарением идёт превращение жидкости в пар по всему объёму — испарение внутрь воздушных пузырьков с последующим выводом пара наружу. Вот почему кипящая жидкость улетучивается очень быстро: чайник, из которого вода испарялась бы много дней, выкипит за полчаса.
В отличие от испарения, происходящего при любой температуре, жидкость начинает кипеть только при достижении температуры кипения — именно той температуры, при которой пузырьки воздуха оказываются в состоянии всплыть и добраться до поверхности. При температуре кипения давление насыщенного пара становится равно внешнему давлению на жидкость (в частности, атмосферному давлению). Соответственно, чем больше внешнее давление, тем при более высокой температуре начнётся кипение.
При нормальном атмосферном давлении ( атм или Па) температура кипения воды равна . Поэтому давление насыщенного водяного пара при температуре равно Па. Этот факт необходимо знать для решения задач — часто он считается известным по умолчанию.
На вершине Эльбруса атмосферное давление равно атм, и вода там закипит при температуре . А под давлением атм вода начнёт кипеть только при .
Температура кипения (при нормальном атмосферном давлении) является строго определённой для данной жидкости величиной (температуры кипения, приводимые в таблицах учебников и справочников — это температуры кипения химически чистых жидкостей. Наличие в жидкости примесей может изменять температуру кипения. Скажем, водопроводная вода содержит растворённый хлор и некоторые соли, поэтому её температура кипения при нормальном атмосферном давлении может несколько отличаться от ). Так, спирт кипит при , эфир — при , ртуть — при . Обратите внимание: чем более летучей является жидкость, тем ниже её температура кипения. В таблице температур кипения мы видим также, что кислород кипит при . Значит, при обычных температурах кислород — это газ!
Мы знаем, что если чайник снять с огня, то кипение тут же прекратится — процесс кипения требует непрерывного подвода тепла. Вместе с тем, температура воды в чайнике после закипания перестаёт меняться, всё время оставаясь равной . Куда же при этом девается подводимое тепло?
Ситуация аналогична процессу плавления: тепло идёт на увеличение потенциальной энергии молекул. В данном случае — на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалёку друг от друга, и жидкость будет переходить в газообразное состояние.