Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
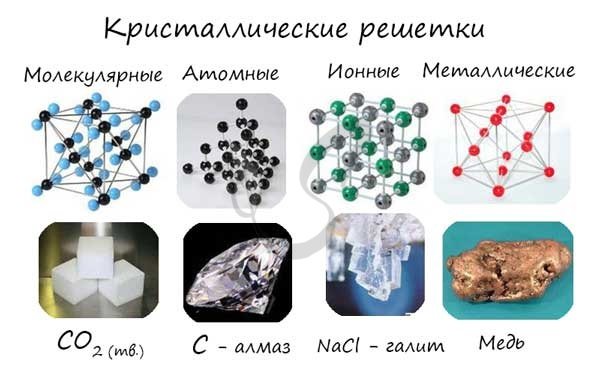
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
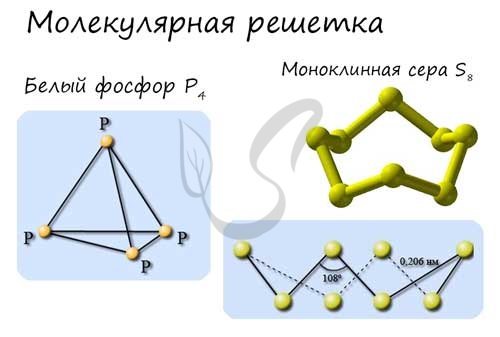
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.

Ионная кристаллическая решетка
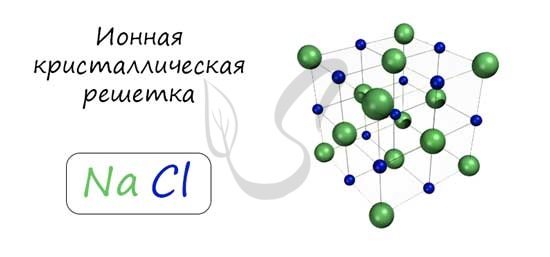
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.

Металлическая кристаллическая решетка
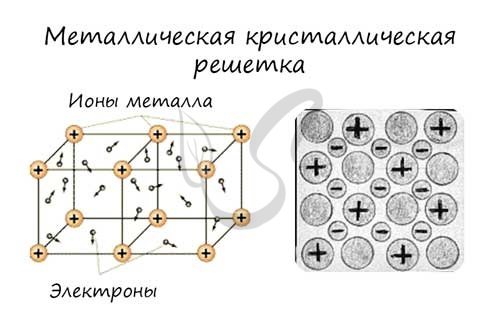
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.

Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).


© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.
Источник
Кристаллическое и аморфное вещество
Кристаллическое вещество: твердое вещество, у которого атомы или молекулы образуют правильную упорядоченную решетку. Большинство твердых веществ существует в кристаллическом состоянии, которое отличается повышенной стабильностью, но это не означает, что они имеют кристаллы в прямом смысле этого слова; например, чистая медь является кристаллической только потому, что ее атомы расположены в регулярном порядке.
Аморфное вещество: твердое вещество, не имеющее кристаллической структуры. Его атомы и молекулы расположены без соблюдения регулярности. Переохлажденные жидкости, такие как стекло, резина и некоторые пластмассы, являются аморфными.
Кристаллическая структура Аморфная структура
Сейчас мы будем рассматривать только кристаллические вещества.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов. Выделяют 4 типа кристаллических решеток (КР): Молекулярная, ионная, металлическая и атомная.
Типы кристаллических решеток
Галогены: F2, Cl2
Галогеноводороды: HF, HCl …
Простые вещества неметаллы:
О2, Н2, N2, P(белый)
CaC2, SiC (карборунд),
Ионные кристаллы
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь. Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов.
Атомные кристаллы
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы. Они очень прочные и твердые, плохо проводят теплоту и электричество.
Молекулярные кристаллы
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл.
Физические свойства меди:
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 132 пм |
| 207 | Радиус иона (кристаллический) | Cu + (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 140 пм |
| 209 | Электроны, Протоны, Нейтроны | 29 электронов, 29 протонов, 35 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 306 | Энергия сродства атома к электрону | 119,235(4) кДж/моль (1,23578(4) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 8,96 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), |
8,02 г/см 3 (при температуре плавления 1084,62 °C и иных стандартных условиях, состояние вещества – жидкость),
7,962 г/см 3 (при 1127 °C и иных стандартных условиях, состояние вещества – жидкость), 7,881 г/см 3 (при 1227 °C и иных стандартных условиях, состояние вещества – жидкость), 7,799 г/см 3 (при 1327 °C и иных стандартных условиях, состояние вещества – жидкость), 7,471 г/см 3 (при 1727 °C и иных стандартных условиях, состояние вещества – жидкость), 7,307 г/см 3 (при 1927 °C и иных стандартных условиях, состояние вещества – жидкость),
7,225 г/см 3 (при 2027 °C и иных стандартных условиях, состояние вещества – жидкость), 7,102 г/см 3 (при 2177 °C и иных стандартных условиях, состояние вещества – жидкость)
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Медь |
| 102 | Прежнее название | |
| 103 | Латинское название | Cuprum |
| 104 | Английское название | Copper |
| 105 | Символ | Cu |
| 106 | Атомный номер (номер в таблице) | 29 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, цветной металл |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 9000 г. до н.э. |
| 111 | Внешний вид и пр. | Пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки) |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0068 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 0,00007 % |
| 123 | Содержание в метеоритах (по массе) | 0,011 % |
| 124 | Содержание в организме человека (по массе) | 0,0001 % |
Дополнительные сведения:
| 402 | Температура плавления* | 1084,62 °C (1357,77 K, 1984,32 °F) |
| 403 | Температура кипения* | 2562 °C (2835 K, 4643 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,26 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 300,4 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,384 Дж/г·K (при 20 °C) |
| 410 | Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 7,1 см³/моль |
| 412 | Теплопроводность | 401 Вт/(м·К) (при стандартных условиях), 401 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 16,5 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | 0,000000001 мм.рт.ст. (при 672°C), 0,00000001 мм.рт.ст. (при 727°C), 0,0000001 мм.рт.ст. (при 787°C), 0,000001 мм.рт.ст. (при 857°C), 0,00001 мм.рт.ст. (при 934°C), 0,0001 мм.рт.ст. (при 1025°C), 0,001 мм.рт.ст. (при 1133°C), 0,01 мм.рт.ст. (при 1264°C), 0,1 мм.рт.ст. (при 1419°C), 1 мм.рт.ст. (при 1617°C), 10 мм.рт.ст. (при 1910°C), 100 мм.рт.ст. (при 2312°C) |
| 420 | Давление паров (Па) | 1 Па (при 1509 K), 100 кПа (при 2834 K) |
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело), 338 кДж/моль (при 298 К, для состояния вещества – газ) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 423 | Стандартная энтропия вещества S | 33,15 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), 166,3 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| 424 | Стандартная мольная теплоемкость Cp | 24,4 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело), |
Медь самородная формула свойства
Синонимы: Купрокупритом были названы тонкие смеси самородной меди и куприта (Вернадский, 1910). Витнеит—whitneyite (Гент, 1859) и дарвинит (Форбс, 1860) — мышьяковистая медь, образующая смеси с альгодонитом.
Группа
Происхождение названия
Латинское наименование меди cuprum происходит от названия острова Кипр, откуда в древности ввозили медь. Происхождение русского названия неясно.
Английское название минерала Медь — Copper
Медный самородок
- Химический состав
- Разновидности
- Кристаллографическая характеристика
- Форма нахождения в природе
- Физические свойства
- Химические свойства. Прочие свойства
- Диагностические признаки. Спутники.
- Происхождение минерала
- Месторождения
- Практическое применение
- Физические методы исследования
- Кристаллооптические свойства в тонких препаратах (шлифах)
- Купить
Химический состав
Содержит иногда примеси Fe, Ag, Pb, Au, Hg, Bi, Sb, V, Ge3 (серебристая медь с 3—4% Ag, железистая—2,5% Fe и золотистая—2—3% Au). Примеси наблюдаются чаще в первичной самородной меди; вторичная медь обычно более чистая. Состав самородной меди из Шамлугского месторождения (Армения): Cu — 97,20 —97,46%, Fe — 0,25%; в меди из месторождений Алтая определено 98,3% Cu и более.
Кристаллографическая характеристика
Сингония. Кубическая.
Класс. Гексоктаэдрический.
Кристаллическая структура
Для кристаллической структуры характерна гранецентрированная решетка; по углам и в центрах граней элементарного куба расположены атомы меди.
Это формальное выражение того, что в структуре меди имеется плотнейшая упаковка (так называемая кубическая плотнейшая упаковка) из атомов металла с радиусом 1,27 А и расстоянием между ближайшими атомами 2,54 А при выполнении пространства в 74,05%.
Каждый атом Cu окружен 12 ему подобными (координационное число 12), располагающимися вокруг него по вершинам так называемого Архимедова кубооктаэдра.
Главные формы:а (100), d (110), о (111), l (530), е (210), h (410).
Форма нахождения в природе
Облик кристаллов. Облик кристаллов кубический, тетрагексаэдрический, додекаэдрический, реже — октаэдрический (возможно, псевдоморфозы по куприту). Грани часто шероховатые, с углублениями или возвышениями. Простые кристаллы редки.
Двойники.
Двойники срастания по (111) обычны, иногда полисинтетические, часто пластинчатые в направлении двойники оси или удлиненные паралелльны диагонали двойники плоскости. Обычно кристаллы (простые и двойники) неравномерно развиты: вытянуты, укорочены или деформированы.
Характерны дендритовидные формы, представляющие собой однообразные срастания множества кристаллов (единообразно деформированных или правильных) по какому-либо одному направлению.
Таковы, например, двойниковые по (111) кристаллы, вытянутые по оси симметрии 2-го порядка и сросшиеся параллельно граням ромбического додекаэдра) или срастания правильных двойниковых кристаллов, разветвляющиеся по направлению ребер и диагоналей октаэдрических граней, а также параллельные срастания кристаллов, вытянутых в направлении осей 4-го порядка. В сплошных выделениях самородной меди при травлении обнаруживаются признаки собирательной кристаллизации с развитием крупных зерен за счет более мелких зональных зерен неправильной формы.
Агрегаты. Искаженные кристаллы, в одиночных неправильных зернах, дендритовидные сростки, нитевидные, проволочные, моховидные образования, тонкие пластинки, конкреции, порошковатые скопления и сплошные массы весом до нескольких сотен тонн.
Дендриты
Оптические
Цвет в свежем изломе светло-розовый, быстро переходящий в медно-красный, затем в коричневый; часто с желтой или пестрой побежалостью.
Черта медно-красная, блестящая.
Блеск металлический.
Отлив
Прозрачность. Непрозрачна. В тончайших пластинках просвечивает зеленым цветом.
Показатели преломления
Ng = , Nm = и Np =
Механические
Твердость 2,5-3.
Плотность 8,4—8,9
Спайность не наблюдается.
Излом занозистый, крючковатый.
Химические свойства
Легко растворяется в разбавленной HNO3 и в царской водке, в H2SO4— при нагревании, в НСl — с трудом. В водном растворе аммиака растворяется, окрашивая его в синий цвет. В полированных шлифах травится всеми основными реактивами. Внутреннее строение легко выявляется с помощью NH4OH + Н2O2 или НСl+ CrO3 (50%-ный раствор).
Прочие свойства
Очень ковка и тягуча. Электропроводность очень высокая; существенно понижается от примесей.
Поведение при нагревании. Чистая медь плавится при 1083°. Теплопроводность несколько меньше, чем у серебра.
Искусственное получение минерала
Может быть легко получена из расплавов или путем электролиза из растворов солей меди.
Диагностические признаки
Сходные минералы
Узнается по красному цвету свежей поверхности, блестящей черте, средней твердости и ковкости, обычно покрыта зеленоватыми, черными, синими налетами окисленных минералов меди. Под микроскопом в отраженном свете легко определяется по цвету и отражательной способности.
Сопутствующие минералы. Медистое золото, халькозин, кальцит, диопсид, апатит, сфен, магнетит, малахит, барит, кварц, халькопирит.
Происхождение и нахождение
Гидротермальное. Накапливается в россыпях. Как уникальные явления описаны самородки массой до 450 т.
Самородная медь образуется в восстановительных условиях при различных геологических процессах; значительная часть ее выделяется из гидротермальных растворов.
В виде микроскопических выделений наблюдается во многих, преимущественно основных, изверженных породах, подвергшихся воздействию гидротермальных растворов, например, в серпентинизированных перидотитах, дунитах и серпентинитах.
В этом случае возникновение самородной меди, возможно, связано с разложением ранее образовавшихся медных сульфидов, например, кубанита (Урал, Закавказье). Аналогичное происхождение можно приписать самородной меди в амфиболитизированных основных породах Серовского района Свердловской области.
В Карабашском месторождении медистого золота Челябинской области самородная медь наблюдается в жилообразных телах диопсидо-гранатовых пород, залегающих среди серпентинитов; для самородной меди здесь характерна ассоциация с медистым золотом, халькозином, кальцитом, диопсидом, апатитом, сфеном, магнетитом и др.
В некоторых древних вулканических породах (мелафирах, диабазах и др.
), метаморфизованных под воздействием паров, газов и гидротермальных растворов, медь выполняет миндалины, образует цемент между минералами измененной лавы, заполняет пустоты и трещины; сопровождается гидротермальными минералами: анальцимом, ломонтитом, пренитом, датолитом, адуляром, хлоритом, эпидотом, пумпелиитом, кварцем, кальцитом. Крупнейшие месторождения этого типа находятся на полуострове Кивино в районе Верхнего озера (штат Мичиган, США), где оруденение приурочено к верхнепротерозойской толще. масса меди добывается из мелафиров и конгломератов, но наиболее крупные выделения меди (до 400 т и более) встречены в кальцитовых жилах, содержащих самородное серебро и домейкит.
Медный самородок
Изменение минерала
Наиболее обычными продуктами изменения самородной меди являются куприт, малахит и азурит.
Месторождения
Выделения самородной меди наблюдались в диабазах Новой Земли, в траппах Сибирской платформы, среди основных эффузивных пород в Италии, на Фарерских островах (Дания), в Новой Шотландии (Канада) и в других местах.
Представителями редких типов гипогенных месторождений самородной меди являются цинково-марганцовое месторождение Франклин (штат Нью-Джерси, США) и марганцовые месторождения Лонгбан и Якобсберг (Швеция).
Гипогенными, по-видимому, являются выделения самородной меди весом до нескольких тонн из ранее разрабатывавшегося месторождения Калмактас в Казахстане, представленные в музеях прекрасными образцами.В зоне окисления, особенно в ее нижних частях, самородная медь в основном является ранним продуктом изменения сульфидных медных минералов, главным образом халькозина.
Она слагает преимущественно выделения неправильной формы, реже — кристаллы и дендритовидные агрегаты.Наиболее часто самородная медь сопровождается халькозином, купритом, кальцитом, лимонитом. Наблюдается в ряде месторождений Казахстана (Джезказган, Беркара, Успенское и др.), Рудного Алтая (Белоусовское, Зыряновское, Чудак, Таловское и др.
), США (Бисби и Клифтон- Моренси в штате Аризона, Тинтик в штате Юта и др.).Частью самородная медь в зоне окисления возникает путем отложения из растворов, содержащих сульфат меди. Такова, например, самородная медь, образующая выделения в полостях среди агрегатов лимонита, иногда в ассоциации с купритом (Меднорудянекое месторождение Свердловской обл. и др.).
Известны псевдоморфозы самородной меди, образовавшиеся в зоне окисления по халькозину, куприту, антлериту, халькантиту, азуриту, кальциту, арагониту и другим минералам.Особенно красивые образцы самородной меди (кристаллы и дендритовидные сростки) происходят из Турьинских рудников Свердловской области.
В некоторых горных выработках из медьсодержащих вод на железных предметах выделяется так называемая цементная медь в виде пленок и корочек. Известны также случаи образования меди на полусгнивших остатках крепежной древесины.
В повышенном количестве самородная медь наблюдается в некоторых осадочных породах (песчаниках, глинах, мергелях), содержащих растительные остатки, в виде выделений неправильной формы, иногда в псевдоморфозах по древесине или в виде конкреций. Таковы, например, пермские медистые песчаники отдельных районов России (Приуралье, Татарстан и др.), песчаники Науката в Киргизияи меловые медистые песчаники Корокоро и Кобрицос в Боливии и др.С восстановительными процессами связано также образование самородной меди в некоторых торфяниках, например,в Свердловской области— по реке Лёвихе в бассейне реки Тагила и в Сысертском районе.
В виде галек и зерен самородная медь встречается в России в некоторых россыпях: на Урале, по Енисею, по реке Б. Сархой в Бурятия, по реке Чорох в Грузии, на Командорских островах и в других местах.
В штате Коннектикут (США) самородная медь обнаружена в ледниковых отложениях в виде выделений весом до 75 кг.
Мелкие, неправильной формы выделения самородной меди отмечены в самородном железе метеорита Венгерово в ассоциации с троилитом.
Кристаллическая решётка меди:
500
| Кристаллическая решётка | ||
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-50-8 |
Примечание:
205* Эмпирический радиус атома меди согласно [1] и [3] составляет 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132±4 пм и 117 пм соответственно.
401* Плотность меди согласно [3] составляет 8,92 г/см 3 (при 0 °C и при нормальных условиях, состояние вещества – твердое тело).
402* Температура плавления меди согласно [3] и [4] составляет 1083,4 °С (1356,55 K, 1982,12 °F) и 1083 °С (1356,15 K, 1981,4 °F) соответственно.
403* Температура кипения меди согласно [3] и [4] составляет 2567 °С (2840,15 K, 4652,6 °F) и 2543 °C (2816,15 К, 4609,4 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) меди согласно [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) меди согласно [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
Источник
Медь — цветной металл планеты номер один
Медь не относится к благородным или редким элементам. Это самый распространенный цветной металл на Земле. Благодаря своим характеристикам в почете у промышленников и ювелиров. Предмет охоты сборщиков лома.
Что представляет собой
Медь – это розоватый металл с золотисто-металлическим блеском. Элемент №29 периодической системы Менделеева. Международное обозначение – Cu (Cuprum).
Чистый металл мягок, поэтому чаще используется с примесями. Пластичен: вытягивается до микронных диаметров.
На воздухе покрывается пленкой, обретая желтовато-красный оттенок. Тонкие пластинки на просвет зеленовато-голубые.
По официальной классификации причислен к тяжелым цветным металлам. В эту же группу входят свинец, цинк, олово, никель.
История
Медь – один из первых металлов, с которыми имело дело человечество. Этому способствовали преимущества: большая распространенность, доступность, относительно низкая температура плавления.
Достоинства меди люди оценили восемь тысячелетий назад.
Медный век начался сразу после каменного:
- Древнейшими признаны медные артефакты, откопанные на территории современной Турции. Это бусинки и декоративные накладки.
- Из металла делали режущий инструментарий и посуду.
- История открытия медных рудников на Руси начинается на Урале за две тысячи лет до новой эры. Затем были Кавказ, Алтай, Сибирь.
- Промышленная переработка с использованием бронзы началась в XIV веке. Из сплава отливали пушки и колокола.
Из бронзы отлиты Царь-колокол и Царь-пушка.
Предполагается, что металл назван по имени острова Кипр. Здесь еще в III веке до нашей эры обнаружились медные залежи, а население освоило выплавку меди.
Происхождение русскоязычного термина медь «Этимологический словарь русского языка» М.Фасмера увязывает с древненемецким корнем smid – кузнец, металл.
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн. тонн.
Физико-химические параметры
Медь – металл с типичными внешними признаками (блеск, гладкость) и структурой кристаллической решетки. Наделена высокой электро- и теплопроводностью. По этим физическим свойствам вторая после серебра.
Название, символ, номерАтомная масса(молярная масса)Электронная конфигурацияРадиус атомаХимические свойстваКовалентный радиусРадиус ионаЭлектроотрицательностьЭлектродный потенциалСтепени окисленияЭнергия ионизации(первый электрон)Термодинамические свойства простого веществаПлотность (при н. у.)Температура плавленияТемпература кипенияУд. теплота плавленияУд. теплота испаренияМолярная теплоёмкостьМолярный объёмКристаллическая решётка простого веществаСтруктура решёткиПараметры решёткиТемпература ДебаяПрочие характеристикиТеплопроводностьНомер CAS
| Медь/Cuprum (Cu), 29 |
| 63,546(3)а. е. м. (г/моль) |
| [Ar] 3d10 4s1 |
| 128 пм |
| 117 пм |
| (+2e) 73 (+1e) 77 (K=6) пм |
| 1,90 (шкала Полинга) |
| +0,337 В/ +0,521 В |
| 3, 2, 1, 0 |
| 745,0 (7,72) кДж/моль (эВ) |
| 8,92 г/см³ |
| 1356,55 K (1083,4 °С) |
| 2567 °С |
| 13,01 кДж/моль |
| 304,6 кДж/моль |
| 24,44 Дж/(K·моль) |
| 7,1 см³/моль |
| кубическая гранецентрированая |
| 3,615 Å |
| 315 K |
| (300 K) 401 Вт/(м·К) |
| 7440-50-8 |
Главное химическое свойство металла, оцененное человеком, – нулевая коррозийность. Медь химически малоактивна, при стандартных условиях не окисляется.
Медь в природе
В природе выявлено два проявления элемента – самородки и компонент соединений с другими элементами.
Самородок меди
Чаще это соединения: оксиды, сульфиды, гидрокарбонаты. Самое распространенное сырье – медный колчедан.
Медь придает глубокие синие, голубые, зеленоватые оттенки малахиту, бирюзе, хризоколле, другим минералам ювелирно-декоративного сегмента.
Способы получения
металла в рудах не превышает 2%. Поэтому перед плавкой их обогащают. Существует два способа получения меди: пиро- и гидрометаллургический.
Многоуровневый процесс, включающий следующие этапы:
- Обогащение. Руды обогащают методом флотации. Взвешенные в воде медные частички «цепляются» к воздушным пузырькам, которые увлекают их на поверхность. На выходе получается порошок-концентрат с 12-36% меди.
- Обжиг. Процедура показана бедным (9-24% меди) медным рудам и кон серой. При прокаливании с кислородом доля серы падает вдвое.
- Плавка. Кусками руды или порошком-концентратом загружают печи шахтного либо отражательного типа при 1452°С. Получают медный штейн.
- Продувка. В конвертерах на него воздействуют сжатым воздухом. Сульфиды и железо окисляются, образуется почти чистая (98,51 — 99,51%) черновая медь плюс железо, другие ценные компоненты в следовых количествах.
- Рафинирование. Черновой продукт отправляют на рафинирование – пламенем, затем электролитом. Примеси удаляются с газами. После первого этапа металл очищается до 99,51%, после заключительного – до 99,96%.
Способ применяется к 9/10 добытого сырья.
Состоит в обработке сырья растворенной серной кислотой малой концентрации и выделении металлического медного продукта.
Метод оптимален для руд с минимальным процентом меди. Извлечения других компонентов не предусматривается.
Сплавы
Номенклатура сплавов меди с другими компонентами насчитывает десятки позиций.
Сплавы меди и их применение
Они применяются чаще чистого металла, поскольку уменьшают недостатки, присущие чистому металлу. То есть делают продукт прочнее, устойчивее, дешевле.
Медные соединения подразделяются на две группы:
- Бронза – с оловом.
- Латунь – с цинком.
Помимо этих главных легирующих компонентов, в составе соединения алюминий, никель, висмут, титан, серебро, золото, неметаллические элементы.
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.
Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника. Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
- Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
Система охлаждения из меди на тепловых трубках в ноутбуке
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.
Кольцо из меди
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
- 25% – розовый;
- 50% – красный.
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.
Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Значение для человека
Медь заложена в организм человека изначально:
- Участвует в образовании красных кровяных телец, коллагена, эластина.
- Активирует работу эндокринной системы, замедляет старение организма.
- Ее дефицит чреват замедлением белкового обмена. Это влечет патологии в развитии скелета и составе крови.
Она есть во многих продуктах питания. Медью богаты говяжья печень, устрицы, кунжут, какао-порошок, черный перец, гречневая крупа. А также орехи (лесной, грецкий, кешью, арахис, миндаль).
Предостережение
В составе металла есть изотопы: два стабильных плюс два десятка нестабильных. Хотя период полураспада «долгожителя» – менее 2,5 суток, материал токсичен.
Поэтому применение меди контролируется.
В России на федеральном уровне (национальный стандарт, федеральный Свод Правил) регламентируется:
- Производство и использование медных водо- паро- и газопроводных труб.
- Количество меди в питьевой воде.
В 1 литре питьевой воды не должно быть больше 1 мг меди.
Избыток медных компонентов вызывает отравление организма. Для приготовления пищи медная посуда непригодна.
Карьер, в котором медную руду извлекали открытым способом, становится источником токсичных соединений.
Цены
Мировая цена меди устанавливается на Лондонской бирже металлов. Она зависит от спроса, определяемого состоянием экономики.
И колеблется соответственно:
- К началу 2008 года преодолена психологическая отметка $8000 за тонну.
- Через полгода было уже $+940, что стало рекордом за всю историю биржи.
- На начало 2011 года взята планка $10 000.
Затем произошел спад. На 2022 год тонна меди торгуется по $8057. Сказалось торможение экономики из-за пандемии коронавируса.
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла.
Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Халькопирит
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции.
Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой.
Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
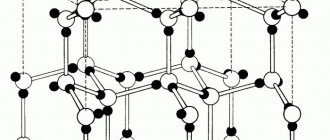
Кристаллическая решетка меди
Подскажите, как выглядит кристаллическая решетка меди? Охарактеризуйте валентные возможности атома меди (необходимо указать электронную формулу меди и число неспаренных электронов).
В виде простого вещества медь представляет собой металл красного цвета. Кристаллическая решетка меди гранецентрированная кубическая. Кристаллическая решетка представляет собой своего рода пространственный каркас, образованный пересекающимися прямыми линиями. В точках пересечения линий – узлах решетки – лежат центры частиц. Кристаллическая решетка меди – молекулярная. Это означает, что в её узлах находятся молекулы. Они связаны друг с другом межмолекулярными силами.
Рис. 1. Схематическое изображение кристаллической решетки меди.
Медь – металл, относится к элементам d-семейства. Электронная конфигурация меди выглядит следующим образом:
.
В кристаллах меди реализуется металлический тип химической связи. Металлической обычно называют связь между атомами металлов в твердом состоянии. В газовой фазе между атомами металлов имеет место обычная ковалентная неполярная связь. При образовании твердого вещества, так же как в любых кристаллах, образуются энергетические зоны – делокализованные молекулярные орбитали. В отличие от ионных кристаллов, энергетические зоны в металлических кристаллах значительно шире и даже могут перекрываться, что связано ч большой степенью перекрывания атомных орбиталей металлов и их высокими координационными числами.
Источник
Атом и молекула меди. Формула меди. Строение атома меди:
Медь (лат. Cuprum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cu и атомным номером 29. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), четвертом периоде периодической системы.
Медь – металл. Относится к группе переходных металлов. Относится к тяжёлым и цветным металлам.
Медь обозначается символом Cu.
Как простое вещество медь при нормальных условиях представляет собой пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки). Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Молекула меди одноатомна.
Химическая формула меди Cu.
Электронная конфигурация атома меди 1s2 2s2 2p6 3s2 3p6 3d10 4s1. Потенциал ионизации (первый электрон) атома меди равен 745,48 кДж/моль (7,726380(4) эВ).
Строение атома меди. Атом меди состоит из положительно заряженного ядра (+29), вокруг которого по четырем оболочкам движутся 29 электронов. При этом 28 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку медь расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома меди – на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома меди состоит из 29 протонов и 35 нейтронов.
Радиус атома меди (вычисленный) составляет 145 пм.
Атомная масса атома меди составляет 63,546(3) а. е. м.
Медь с давних пор широко используется человеком.
Медь, свойства атома, химические и физические свойства
1.1. Аморфные и кристаллические тела
В твердых телах атомы могут размещаться в пространстве двумя способами:
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
Внешние электронные орбиты атомов соприкасаются, так что плотность упаковки
атомов в кристаллической решетке весьма велика.
В кристаллитах соблюдаются ближний и дальний порядки. Это означает наличие упорядоченного расположения и стабильности как окружающих данный атом ближайших его соседей (ближний порядок
), так и атомов, находящихся от него на значительных расстояниях вплоть до границ зерен (
дальний порядок
).
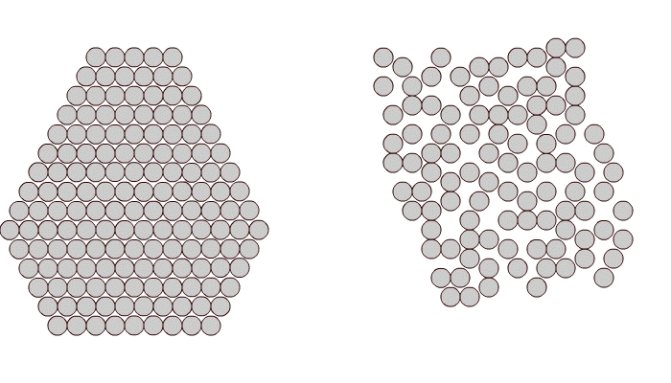

Рис. 1.1. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Вследствие диффузии
отдельные атомы могут покидать свои места в узлах кристаллической решетки, однако при этом упорядоченность кристаллического строения в целом не нарушается.
Кристаллическое и аморфное вещество
Кристаллическое вещество: твердое вещество, у которого атомы или молекулы образуют правильную упорядоченную решетку. Большинство твердых веществ существует в кристаллическом состоянии, которое отличается повышенной стабильностью, но это не означает, что они имеют кристаллы в прямом смысле этого слова; например, чистая медь является кристаллической только потому, что ее атомы расположены в регулярном порядке.
Аморфное вещество: твердое вещество, не имеющее кристаллической структуры. Его атомы и молекулы расположены без соблюдения регулярности. Переохлажденные жидкости, такие как стекло, резина и некоторые пластмассы, являются аморфными.
Кристаллическая структура Аморфная структура
Сейчас мы будем рассматривать только кристаллические вещества.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов. Выделяют 4 типа кристаллических решеток (КР): Молекулярная, ионная, металлическая и атомная.
Типы кристаллических решеток
Галогены: F2, Cl2
Галогеноводороды: HF, HCl …
Простые вещества неметаллы:
О2, Н2, N2, P(белый)
CaC2, SiC (карборунд),
Ионные кристаллы
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь. Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов.
Атомные кристаллы
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы. Они очень прочные и твердые, плохо проводят теплоту и электричество.
Молекулярные кристаллы
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл.
1.2. Основные типы кристаллических решеток
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ
). Такой тип структуры называется
металлической связью
.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
объемно-центрированная кубическая (ОЦК)
гранецентрированная кубическая (ГЦК)
гексагональная плотноупакованная (ГП)
(6 атомов на ячейку)
Рис. 1.2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 1.2,б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с
параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с
/
а
всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметры а
кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой
а
лежит в пределах 0,228-0,398 нм, а
с
в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом
понимается количество ближайших соседей данного атома.
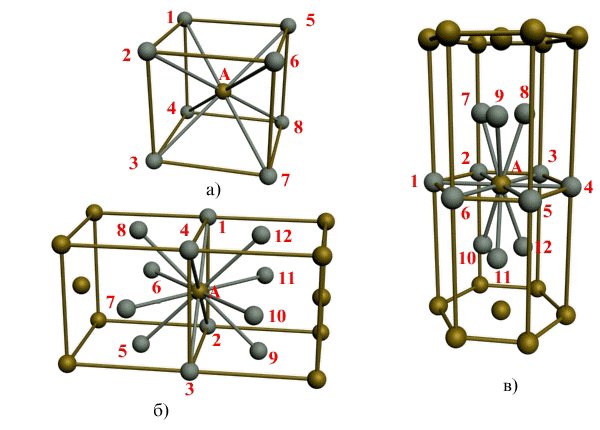

Рис. 1.3. Координационное число в различных кристаллических решетках для атома А:
В ОЦК решетке (рис. 1.3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К8).
В ГЦК решетке (рис. 1.3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов /,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам 5,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К12).
В ГПУ решетке при с/а =
1,633 (рис. 1.3, в) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов /,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а «поры» 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na + ) и отрицательных (Cl — ) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
1.3. Кристаллографические направления и плоскости
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости.
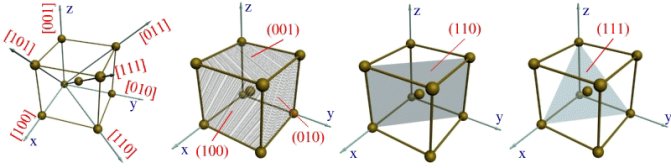

Кристаллографическими плоскостями являются, например, плоскости граней кубов (рис. 1.4, б), а также их различные диагональные плоскости вместе с находящимися на них атомами (рис. 1.4, в, г). Для ГПУ-решеток кристаллографическими плоскостями могут быть плоскости оснований (рис. 1.2, г).
Для определения индекса какого-либо направления необходимо найти индекс ближайшего к данной точке отсчета атома, находящегося на данном направлении. Например, индекс ближайшего атома вдоль оси ОХ
обозначается цифрами 100 (рис. 1.4,а). Эт и цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX,
OY
и
OZ
соответственно.
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY
и
OZ
обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней
XOZ, XOY
и
YOZ
обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится так: [111].
Индексами плоскостей, параллельных плоскостям XOZ
и
YOZ,
окажутся выражения (010) и (100) (рис. 1.4, б). Индекс вертикальной диагональной плоскости куба выразится через (110), (рис. 1.2, в), а индекс наклонной плоскости, пересекающейся со всеми тремя осями координат на удалении одного параметра, примет вид (111) (см. рис. 1.4, г).
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
1.4. Анизотропия в кристаллах
Под анизотропией
понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она является естественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
Например, в кубических решетках (см. рис. 1.2, б, в) по направлениям вдоль ребер насчитывается меньше атомов, чем вдоль диагоналей куба в ОЦК-решетке или диагоналей граней в ГЦК-решетке. На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными.
Рис. 1.5. Элементарная ячейка решетки ОЦК
Сдвиг в кристалле происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов. Рассмотрим объемно-центрическую кубическую решетку (ОЦК) (рис. 1.5):
Рис. 1.6. Плоскости решетки ОЦК
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
1.5. Аллотропия металлов
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии
или
полиморфизма
, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
На рис. 1.7 показано изменение свободной энергии
F
от температуры
t
для двух вариантов кристаллического строения железа: ОЦК (кривая
1
) и ГЦК (кривая
2).
В интервале температур 911-1392 о C железо имеет решетку ГЦК, так как при этом его свободная энергия меньше. При t 1392°С, у него должна быть решетка ОЦК, обладающая меньшей свободной энергией.
Виды кристаллических решёток
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками. Места, в которых находятся сами молекулы, ионы или атомы, называют узлами. А расстояния между узлами получили название – периоды идентичности. В зависимости от положения частиц в пространстве, различают несколько типов:
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
1.6. Дефекты кристаллической решетки металла
Кристаллическая решетка, в которой отсутствуют нарушения сплошности и все узлы заполнены однородными атомами называется идеальной кристаллической решеткой металла.
В решетке реального металла могут находиться различные дефекты.
Все дефекты кристаллической решетки принято делить на точечные, линейные, поверхностные и объемные.
Точечные дефекты соизмеримы с размерами атомов. К ним относятся вакансии, т. е. незаполненные узлы решетки, межузельные атомы данного металла (рис 1.8), примесные атомы замещения, т. е. атомы, по диаметру соизмеримые с атомами данного металла и примесные атомы внедрения, имеющие очень малые размеры и поэтому находящиеся в междоузлиях (рис 1.9). Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера.
Рис. 1.8. Схема образования пары вакансия-внедренный атом
Рис. 1.9. Примесные атомы внедрения и замещения
Линейные дефекты имеют длину, значительно превышающую их поперечные размеры. К ним относятся дислокации
, т. е. дефекты, образующиеся в решетке в результате смещений кристаллографических плоскостей.
Дислокации бывают двух видов.
Наиболее характерной является краевая дислокация
(рис. 1.10). Она образуется в результате возникновения в решетке так называемой полуплоскости или экстраплоскости.
Рис. 1.10. Схема краевой дислокации в идеальном кристалле
Нижний ряд экстраплоскости собственно и принято называть дислокацией.
Другим типом дислокации является винтовая дислокация
, которая представляет собой некоторую условную ось внутри кристалла, вокруг которой закручены атомные плоскости (рис.1.11).
Рис. 1.11. Схема винтовой дислокация
В винтовой дислокации, так же как в краевой, существенные искажения кристаллической решетки наблюдаются только вблизи оси, поэтому такой дефект может быть отнесен к линейным.
Дислокации обладают высокой подвижностью, поэтому существенно уменьшают прочность металла, так как облегчают образование сдвигов в зернах-кристаллитах под действием приложенных напряжений.
Дислокационный механизм сдвиговой пластической деформации
внутри кристаллов может привести к разрушению изделия. Таким образом, дислокации непосредственно влияют на прочностные характеристики металла.
На рис. 1.12 в виде кривой ABC
схематически показана зависимость прочности металла от плотности дислокаций. Точка
А
соответствует теоретической прочности металла, обусловленной необходимостью одновременного разрыва всех межатомных связей, проходящих через плоскость сдвига, в случае отсутствия дислокаций.
При увеличении количества дислокаций (см. участок АВ)
прочность резко снижается, так как на несколько порядков уменьшаются усилия, необходимые для осуществления сдвигов в зернах металла при его деформировании и разрушении.
Рис. 1.12. Зависимость предела прочности кристалла от плотности линейных дефектов(дислокаций). Кривая Одинга
При плотности дислокаций 10 6- 10 7 см-2 (точка В
на кривой), прочности минимальна, и на участке
ВС
происходит ее рост. Это объясняется тем, что с ростом плотности дислокаций их передвижение происходит не только по параллельным, но и по пересекающимся плоскостям, что существенно затрудняет процесс деформирования зерен.
Поэтому начиная с точки В
прочность металла возрастает.
Поверхностные дефекты
включают в себя главным образом границы зерен (рис.1.13). На границах кристаллическая решетка сильно искажена. В них скапливаются перемещающиеся изнутри зерен дислокации.
Из практики известно, что мелкозернистый металл прочнее крупнозернистого. Так как у последнего меньше суммарная протяженность (площадь) границ. То можно сделать вывод, что поверхностные дефекты способствуют повышению прочности металла. Поэтому создано несколько технологических способов получения мелкозернистых сплавов.

Рис.1.13. Структура границы двух соседних кристаллических зерен
Объемные дефекты
кристаллической решетки включают трещины и поры. Наличие данных дефектов, уменьшая плотность металла, снижает его прочность.
Кроме того, трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения создаваемые в металле рабочими нагрузками. Последнее обстоятельство наиболее существенно влияет на прочность металла.
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные, так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Атомная кр. решётка плохо распространена в природе, к ней относятся: кварц, бор, песок, кремний, оксид кремния (IV), германий, горный хрусталь. Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.