Алюминий

Алюминий
— очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Алюминий |
| 102 | Прежнее название | |
| 103 | Латинское название | Aluminium |
| 104 | Английское название | Aluminium, Aluminum (в США и Канаде) |
| 105 | Символ | Al |
| 106 | Атомный номер (номер в таблице) | 13 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, лёгкий, цветной металл |
| 109 | Открыт | Ханс Кристиан Эрстед, Дания, 1825 г. |
| 110 | Год открытия | 1825 г. |
| 111 | Внешний вид и пр. | Мягкий, лёгкий и пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 8,1 % |
| 120 | Содержание в морях и океанах (по массе) | 5,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,005 % |
| 122 | Содержание в Солнце (по массе) | 0,006 % |
| 123 | Содержание в метеоритах (по массе) | 0,91 % |
| 124 | Содержание в организме человека (по массе) | 0,00009 % |
СТРУКТУРА
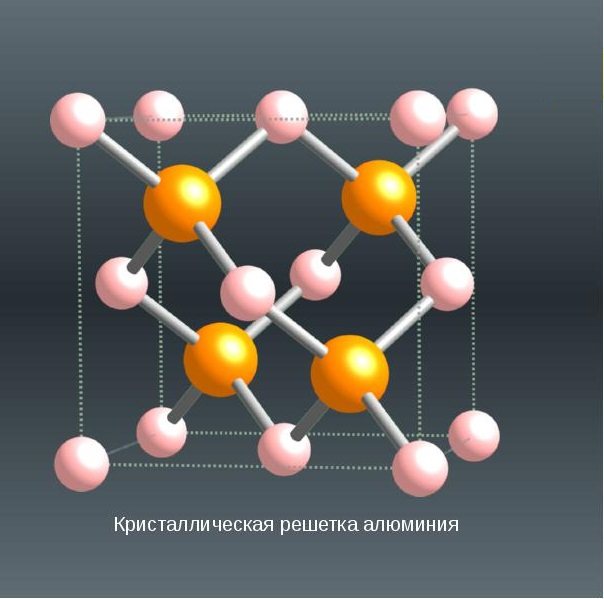

Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10 -10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10 -10 м, а атомный объем 9,999×10 -6 м 3 /г-атом. Примеси в алюминии незначительно влияют на величину параметра решетки. Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10 -5 см), но прочной пленкой оксида алюминия А123, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
Физические свойства алюминия:
| 400 | Физические свойства | |
| 401 | Плотность* | 2,70 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 2,375 г/см3 (при температуре плавления 660,32 °C и иных стандартных условиях, состояние вещества – жидкость), 2,289 г/см3 (при 1000 °C и иных стандартных условиях, состояние вещества –жидкость) |
| 402 | Температура плавления* | 660,32 °C (933,47 K, 1220,58 °F) |
| 403 | Температура кипения* | 2470 °C (2743 K, 4478 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 10,71 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 284 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,903 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 24,20 Дж/(K·моль) |
| 411 | Молярный объём | 9,993 см³/моль |
| 412 | Теплопроводность | 237 Вт/(м·К) (при стандартных условиях), 237 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 23,1 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
СВОЙСТВА
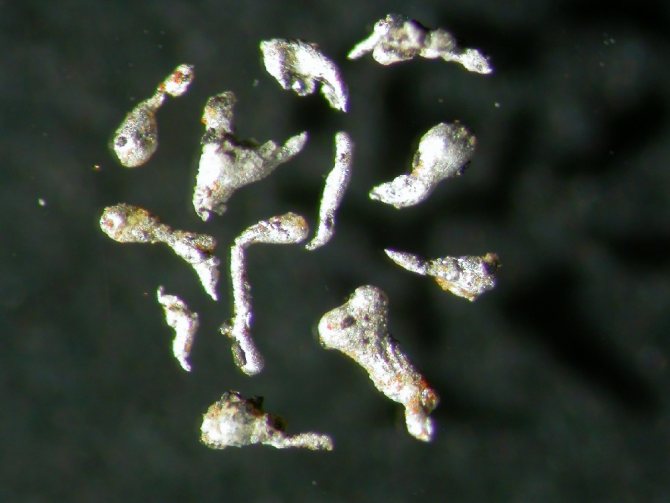

Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см 3 ), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА


По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%. Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ


Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ


Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем. Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Источник
Нахождение в природе
Алюминий — химический элемент III группы Периодической системы элементов Д.И. Менделеева. Вследствие высокой химической активности алюминий в природе находится только в связанном виде. По содержанию в земной коре он (в форме его соединений) занимает первое место среди металлов — 8,13% и третье место после кислорода и кремния. По данным акад. А.Е. Ферсмана, насчитывается более 250 минералов алюминия, которые преимущественно сосредоточены вблизи поверхности земли, и более 40 % из них относится к алюмосиликатам. Практически единственным методом получения металлического алюминия является электролиз криолитоглиноземного расплава. Основное сырье для этого процесса — глинозем (Al2О3) получают различными гидрохимическими методами путем переработки минералов, содержащих соединения алюминия.
Строение атома и кристаллическая решетка
В Периодической системе Д.И. Менделеева порядковый номер алюминия 13, его атомная масса составляет 26,9815 (по углероду 12 С) и 26,98974 (по кислороду 16 O).
Основным изотопом является 27 Al, который устойчив и состоит из 14 нейтронов и 13 протонов. Кроме одного изотопа 26 Al, период полураспада которого равен 10 6 лет, установлено существование еще шести изотопов с массовыми числами 23, 24, 25, 26, 28 и 29 и с малыми периодами полураспада (от 0,13 до 396с), а также пренебрежимо малой распространенностью в природе (от 2×10 -5 до 1,5×10 -4 %).
Алюминий трехвалентен, и 13 его электронов распределены на электронных оболочках ls
2
, 2s
2
,
2р 6 ,
3
s2
, 3
р 1 .
На внешнем электронном слое
М
находятся три валентных электрона: два на 3
s
-орбите с потенциалами ионизации 1800 и 2300 кДж/моль и один на 3
p
-орбите с потенциалом 574,5 кДж/моль, и поэтому в химических соединениях алюминий обычно трехвалентен (Al 3+ ). Так как электрон на
p
-орбите с ядром атома связан слабее, чем два спаренных электрона на s-орбите, то при определенных условиях, теряя р-электрон, атом алюминия становится одновалентным ионом (Al + ), образуя соединения низшей валентности (субсоединения), и еще реже — Al 2+ .
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10 -10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10 -10 м, а атомный объем 9,999×10 -6 м 3 /г-атом . Примеси в алюминии незначительно влияют на величину параметра решетки.
Свойства атома алюминия:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 26,9815386(8) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p1 |
| 203 | Электронная оболочка | K2 L8 M3 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 118 пм |
| 205 | Эмпирический радиус атома* | 125 пм |
| 206 | Ковалентный радиус* | 121 пм |
| 207 | Радиус иона (кристаллический) | Al3+ 53 (4) пм, 67,5 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 184 пм |
| 209 | Электроны, Протоны, Нейтроны | 13 электронов, 13 протонов, 14 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 13-ая группа (по старой классификации – главная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения |
Химическая активность
Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10 -5 см), но прочной пленкой оксида алюминия Al23, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
Химические свойства алюминия:
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,61 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 577,54 кДж/моль (5,985769(3) эВ) |
| 305 | Электродный потенциал | Al3+ + 3e— → Al, Eo = -1,663 В |
| 306 | Энергия сродства атома к электрону | 41,762(5) кДж/моль (0,43283(5) эВ) |
Тип кристаллической решетки алюминия
Для решения задачи, мне нужно указать тип кристаллической решетки алюминия. Буду очень признателен тому, кто поможет мне в этом деле. А еще, нужны способы получения алюминия.
Отображением пространственной структуры монокристалла служит его кристаллическая решетка. Таким образом, различие геометрических форм кристаллов тех или иных веществ связано с особенностями симметрии их кристаллических решеток. Обычно оценивают следующие элементы симметрии в монокристалле: оси симметрии, плоскости симметрии и центры симметрии. Если при повороте на определенный угол вокруг воображаемой оси кристаллическая решетка совмещается сама с собой, то это свидетельствует о наличии в кристалле оси симметрии. Если в кристалле можно провести одну или несколько плоскостей таким образом, что одна часть кристаллической решетки будет зеркальным отображением другой, значит в кристалле имеются плоскости симметрии. Наконец, когда отражение всех узлов решетки в какой-либо точке кристалла приводит к их совмещению, говорят о существовании центра симметрии. Кристаллическая решетка представляет собой своего рода пространственный каркас, образованный пересекающимися прямыми линиями. В точках пересечения линий – узлах решетки – лежат центры частиц.
Рис. 1. Схематическое изображение кристаллической решетки алюминия.
Тип кристаллической решетки алюминия — молекулярная гранецентрированная кубическая. Это означает, что в её узлах находятся молекулы. Они связаны друг с другом межмолекулярными силами. Алюминий – металл, относится к элементам p-семейства. Электронная конфигурация алюминия выглядит следующим образом:
.
На внешнем энергетическом уровне алюминия находится 3 электрона, из которых один неспаренный. Два из вышеуказанных валентных электронов находятся на s-орбитали, а один – на p-орбитали. s- и p-уровни в изолированных атомах близки. Это означает, что соответствующие зоны в кристаллах алюминия перекрываются. Следовательно, число валентных электронов недостаточно для заполнения энергетических уровней перекрывающихся зон. Таким образом, металлические кристаллы образуются элементами, в атомах которых число валентных электронов мало по сравнению, с числом энергетически близких валентных орбиталей. Вследствие этого химическая связь в металлических кристаллах сильно делокализована.
Источник
Кристаллическая решётка алюминия:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 4,050 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 394 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |