Химическое соединение
Карбид кальция
| Имена | |
| Предпочтительное название IUPAC Ацетилид кальция | |
| Систематическое название ИЮПАК Этиндиид кальция | |
| Другие имена Перкарбид кальция Карбид кальция Дикарбид кальция | |
| Идентификаторы | |
| Количество CAS |
|
| 3D модель (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.772 |
| Номер ЕС |
|
| PubChem CID |
|
| UNII |
|
| Панель управления CompTox (EPA) |
|
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
| Химическая формула | CaC2 |
| Молярная масса | 64.099 г / моль |
| Внешность | От белого порошка до серых / черных кристаллов |
| Плотность | 2.22 г / см3 |
| Температура плавления | 2160 ° С (3920 ° F, 2430 К) |
| Точка кипения | 2300 ° С (4170 ° F, 2570 К) |
| Растворимость в воде | Быстрый гидролиз |
| Структура | |
| Кристальная структура | Тетрагональный [1] |
| Космическая группа | D174ч, I4 / ммм, tI6 |
| Координационная геометрия | 6 |
| Термохимия | |
| Стандартный моляр энтропия (S о298) | 70 Дж · моль−1· K−1 |
| Станд. Энтальпия формирование (ΔжЧАС ⦵298) | −63 кДж · моль−1 |
| Опасности | |
| Главный опасности | Реагирует с водой с выделением ацетилен газ[2] |
| Пиктограммы GHS | |
| Сигнальное слово GHS | Опасность |
| Формулировки опасности GHS | H260 |
| NFPA 704 (огненный алмаз) | 4 1 2 W |
| Самовоспламенение температура | 305 ° С (581 ° F, 578 К) (ацетилен) |
| Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Y проверять (что YN ?) | |
| Ссылки на инфобоксы | |
Карбид кальция
, также известный как
ацетилид кальция
, это химическое соединение с химическая формула из C2. Его основное промышленное использование — производство ацетилен и цианамид кальция.[3]
Чистый материал бесцветен, однако кусочки технический карбид кальция серого или коричневого цвета и состоит примерно на 80–85% из CaC2 (остальное — CaO (оксид кальция), Ca3п2 (фосфид кальция), CaS (сульфид кальция), Ca3N2 (нитрид кальция), SiC (Карбид кремния), так далее.). При наличии следов влаги технический карбид кальция издает неприятный запах, напоминающий запах чеснока.[4]
Применение карбида кальция включает производство ацетилен газа, а также для производства ацетилена в карбидные лампы; производство химикатов для удобрений; и в сталеплавильном производстве.
Производство
Карбид кальция промышленно производится в электродуговая печь из смеси Лайм и кокс примерно при 2200 ° C (3990 ° F).[5] Это эндотермическая реакция требуется 110 килокалорий (460 кДж) на моль[6] и высокие температуры для удаления окиси углерода. Этот метод не изменился с момента его изобретения в 1892 году:
CaO + 3 C → CaC2 + CO
Высокая температура, необходимая для этой реакции, практически недостижима при традиционном сжигании, поэтому реакцию проводят в электродуговой печи с графит электроды. Полученный карбидный продукт обычно содержит около 80% карбида кальция по весу. Карбид измельчается, образуя небольшие комочки размером от нескольких до 50 мм. Примеси концентрируются в более мелких фракциях. ЦК2 Содержание продукта определяют путем измерения количества ацетилена, образующегося при гидролизе. Например, британские и немецкие стандарты содержания более крупных фракций составляют 295 л / кг и 300 л / кг соответственно (при давлении 101 кПа и температуре 20 ° C (68 ° F)). Примеси, присутствующие в карбиде, включают фосфид, который производит фосфин при гидролизе.[7]
Эта реакция была важной частью Индустриальная революция в химии, и это стало возможным в Соединенных Штатах в результате огромного количества недорогих гидроэлектростанция произведено на Ниагарский водопад до рубежа 20-го века.[8]
Способ производства в электродуговая печь был открыт в 1892 г. Т. Л. Уилсон и независимо Х. Муассан в том же году.[9][10][11] В Босния и Герцеговина город Jajce Австрийский промышленник, доктор Йозеф Кранц и его «Bosnische-Elektrizitäts AG»
компания, преемником которой впоследствии стал
«Электро-Босна»
, в 1899 году открыл крупнейший в Европе химический завод по производству карбида кальция. Гидроэлектростанции электростанция на Плива для электроснабжения завода построена река установленной мощностью 8 МВт. Это была первая в своем роде электростанция в Юго-Восточной Европе, которая была введена в эксплуатацию 24 марта 1899 года.[12]
Технология производства карбида кальция
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
Белорусский государственный экономический университет
Кафедра технологии
ОТЧЁТ
По индивидуальной работе на тему «Технология производства карбида кальция»
выполнил студент
2 курса, УЭФ, ДЭП – 3
МИНСК
2010
Содержание
Введение………………………………………………………………………………………………3
1.Описание технологических процессов производства и выбор оптимальной схемы…………………………………………………………………………………………………………4
2. Экономическое обоснование оптимальной схемы…………………………………..11
3. Расчёт материального баланса и динамики трудозатрат………………………….13
Заключение……………………………………………………………………………………………….18
Введение
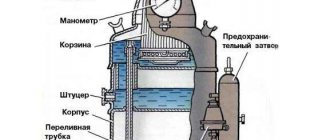
Карбид кальция является химическим соединением кальция с углеродом и используется для получения ацетилена. По внешнему виду представляет собой твердое вещество темно-серого или коричневого цвета. Карбид кальция жадно поглощает воду. Он быстро разлагается на воздухе под влиянием содержащихся в нем паров воды. Карбид кальция получается сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Технический карбид кальция содержит до 80% химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и др. Карбид кальция выпускается двух сортов: первого и второго. Ввиду того, что карбид кальция легко поглощает атмосферную влагу и при этом разлагается с выделением ацетилена, образующего с воздухом взрывоопасную смесь, его хранят и транспортируют в герметически закрытых барабанах. Стандартные карбидные барабаны изготовляются из кровельного железа толщиной не менее 0,5 мм, емкостью 100 и 130 кг. Вместо барабанов для перевозки и хранения карбида кальция применяют также бидоны, изготовленные из листовой малоуглеродистой стали, снабженные герметичной крышкой и резиновой прокладкой. Барабаны с карбидом кальция должны храниться в сухих хорошо проветриваемых помещениях. Нужно вскрывать карбидные барабаны неискрящим инструментом (например, зубилом и молотком из латуни или специальным ножом типа консервного). Вскрытые барабаны после частичного отбора из них карбида кальция должны вновь герметически закрываться крышкой с резиновой прокладкой. Если их плотно закрыть нельзя, то карбид кальция из барабанов необходимо пересыпать в герметически закрывающиеся бидоны. Такие меры необходимы для того, чтобы влага воздуха не разлагала карбид кальция. При транспортировке барабаны нужно укрывать брезентом.
Карбид кальция применяют для получения ацетилена и в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук. Кроме того, из карбид кальция получают синтетический каучук, винилхлорид, акрилонитрил, уксусную кислоту, этилен, хлорпроизводные ацетилена, искусственные смолы, ацетон, стирол. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
- Описание технологических процессов производства и выбор оптимальной схемы
Технический карбид кальция получают в руднотермических печах, где окись кальция и углерод взаимодействуют в электрической дуге согласно уравнению:
СаО+3С=Са
+ СО — 465,99 МДж
Процесс происходит с поглощением большого количества тепла, выделяющегося при прохождении электрического тока через слой загруженной шихты, расплава от электродов к поду печи, а также за счет тепла, выделяемого электрической дугой. Карбидные печи работают как дуговые печи сопротивления.
На современных мощных заводах в качестве сырья используют известняк и углеродсодержащие материалы — кокс и антрацит. Известняк обжигают в шахтных пересыпных печах; топливом служат кокс и тощие угли, загружаемые в печь вместе с известняком. Существуют конструкции печей, где в зону горения возможна подача природного или печного газа.
В верхней части печи отходящие газы отдают тепло загруженной шихте, которая прогревается, а в нижней части известь охлаждается поддуваемым воздухом, который одновременно подогревается. Это повышает тепловой к.п.д. и обеспечивает нормальную работу загрузочных и выгрузных устройств. Основное условие, обеспечивающее устойчивую работу печи, — положение зоны воспламенения кокса в средней части печи. При опускании зоны горения температура выгружаемой извести повышается, а это может привести к разрушению транспортерной ленты, ухудшению теплового к. п. д. Подъем зоны горения вызывает повышение температуры отходящих газов, нарушение режима работы загружающих устройств, ухудшение теплового к. п.д. Кокс воспламеняется при достижении 600—650 °С и температура шихты за счет горения повышается до 900—1000 °С.
В зоне горения кокса идет разложение известняка по реакции: СаС03 =СаО + С02. Давление С02 достигает 0,25 атм при 700 °С [2]. Фактически обжиг ведут при 900—1200 °С. Некоторый перегрев необходим для увеличения скорости разложения, лимитируемой теплоподводом в глубь кусков. Обычно для кусков известняка 200—250 мм и 1000 °С необходимое время пребывания в зоне обжига 2—3 ч. Повышение температуры в зоне обжига выше 1200 oС недопустимо, так как это может вызвать плавление зольных примесей и спекание шихты.
Полученную известь дробят на куски размером менее 50 мм; куски размером менее 5 мм (мелочь) отсевают. Присутствие мелких фракций недопустимо, так как они ухудшают газопроницаемость шихты, нарушают нормальный режим работы карбидной печи. Кроме того, с мелочью отсеиваются зольные примеси.
Кокс или антрацит перед подачей в печь сушат. Подобная операция необходима для устранения влаги, которая может вызвать гашение извести и образование мелочи. Кроме того, удаление воды из печи и реакция восстановления: Н20 + С->Н2 + СО требуют дополнительного расхода кокса и электроэнергии. Сушку проводят в бункерах хранения кокса, в сушильных барабанах; в качестве топлива применяют печной газ. Во избежание воспламенения кокса, продукты сгорания разбавляют воздухом для снижения их температуры до 200—300 °С.
Принципиальная схема производства карбида кальция выглядит следующим образом:
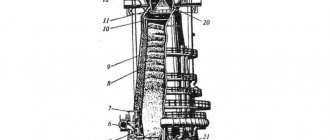
Рассмотрим подробнее работу карбидной печи.
Наблюдения за работой электропечей показали, что в них могут быть выделены следующие основные зоны. Верхняя зона 1 — зона твердофазных процессов. Здесь происходит нагрев шихты, термическая деструкция и твердофазные реакции. Последние, наряду с реакцией взаимодействия углерода с возгоняющимися из нижних зон парами кальция, приводят к появлению карбида кальция. Зона 2 — зона плавления. В этой зоне температура достаточна для плавления минеральной части шихты. Плавление может быть вызвано появлением эвтектических составов, содержащих 50 вес.% СаС2 и плавящихся при 1850—1750 °С. В том случае, если реакции между углеродом и парами кальция или твердой СаО развиты незначительно, зона плавления может отсутствовать.
Образовавшийся расплав обладает достаточной подвижностью и стекает в нижние зоны печи. Этой подвижностью не обладает углеродсодержащий материал. Его плотность меньше плотности расплава и поэтому он всплывает, т.е. вытесняется в верхнюю зону расплава. В эту зону с шихтой непрерывно поступают новые порции углеродсодержащего материала. В результате образуется зона, богатая углеродом. Ее следует выделить в самостоятельную зону 3 — углеродистую. Именно в ней обеспечен достаточный контакт расплава с углеродом; в эту зону поступает активный компонент — СаО — либо в твердом виде (растворяясь в ней), либо поступая с «первичным» эвтектическим расплавом. Размеры третьей зоны определяют производительность печи и качество продукта. Зона 4 — зона чистого расплава может иметь значительные размеры при задержке слива либо перед сливом. При отсутствии материального обмена с предыдущей зоной химические реакции в четвертой зоне можно не учитывать.
При рассмотрении электрических полей определяющим является электропроводность среды в различных зонах. В зоне 1 электропроводность минимальна, поскольку контакт между проводящим углеродjсодержащим материалом нарушен кусками извести, а температура относительно невелика. В зоне 2 электропроводность несколько увеличивается, а в зоне 3 достигает максимального значения, так как в ней электропроводящий расплав обеспечивает контакт между кусками кокса.
Таким образом, торцы электродов должны находиться в углеродистой зоне 3.
Если они расположены выше уровня зоны, электрический контакт нарушится. Опускание их ниже уровня зоны приведет к падению электросопротивления и росту тока. Величина же последнего лимитируется мощностью трансформатора. Следовательно, положение и размер углеродистой зоны определяют положение электрода — важнейшего показателя работы печи. При параллельном соединении проводников максимальная мощность выделяется в том из них, сопротивление которого минимально. Поэтому углеродистая зона является и зоной выделения тепловой энергии.
В том случае, если линия тока замыкается на подине, значительная часть энергии будет выделяться в зоне 4 чистого расплава. Это вызовет перегрев расплава и возникновение конвективных потоков, которые приведут к передаче тепла в верхнюю, т. е. углеродистую зону.
Итак, углеродистая зона является определяющей с точки зрения электрических, тепловых и химических процессов. Поскольку она четко ограничена верхними и боковыми границами, ее можно рассматривать изолировано как химический реактор, в котором происходят химические и тепловые процессы.
Были исследованы пробы, взятые из различных мест ванны печи в период ее остановки. На расстоянии 650 мм от внутренней стенки печи химический состав образцов изменялся так, что содержание углерода возросло на глубине 1900— 2200 мм. Очевидно, на этой глубине начинает образовываться углеродистый слой. Соответственно, содержание СаО здесь уменьшается.
Содержание MgO достигает максимума в верхних зонах — в них идет окисление магния, выносимого газом из расплава окисью углерода, и конденсация MgO на твердой шихте. В результате этого содержание MgO в твердой шихте возрастает почти в 10 раз по сравнению с исходной.
Увеличенное содержание Si02 в образцах, отобранных на глубине 1200 мм, говорит также о возгонке кремния и конденсации его паров в верхних слоях шихты, подобно тому, как это свойственно парам магния. Исследования проводили на круглой печи с расположением электродов по треугольнику. Было обнаружено, что время схода шихты от уровня колошника до расплава составляет: 10 мин для фазы 20—25 мин для фазы 2 и 3,5 ч для фазы 1. Эти данные говорят как о неравномерности карбидообразования под каждым электродом в период исследования, так и о наличии изолированных реакционных пространств (фаз). Между этими пространствами, однако, возможен обмен, который иногда очень эффективен. На практике следует стараться соблюдать такой режим работы печи, чтобы реакционные зоны всех фаз сообщались между собой. Иногда для достижения этого приходится неравномерно корректировать состав шихты под разными электродами. На мощных печах реакционные зоны, как правило, объединены и слив карбида кальция осуществляется через одну летку. Замеры температуры по глубине ванны показывает ее равномерное возрастание от 200 до 1000 °С с температурным градиентом около 30 град.
В процессе эксплуатации карбидной печи необходимо обеспечить максимальную мощность при оптимальном литраже и нормальном положении электрода. Последний определяется размерами углеродистой зоны. С некоторыми допущениями найдено, что вес кокса в этой зоне G(bt) связан с мощностью печи Р (в кВт*ч), с содержанием СаС2 в карбиде (в вес. %) и с размером кусков кокса соотношением
G =
{μPrγ/β (100— [СаС2])} • 106
где μ — безразмерный коэффициент;
γ — плотность углеродсодержащего материала;
β—константа скорости реакции;
q — удельный расход электроэнергии.
Приложения
Производство ацетилена
Реакция карбида кальция с водой с образованием ацетилена и гидроксид кальция,[5] был обнаружен Фридрих Вёлер в 1862 г.
CaC2() + 2H2О(водный) → C2ЧАС2(грамм) + Са (ОН)2(водн.)
Эта реакция легла в основу промышленного производства ацетилен, и является основным промышленным применением карбида кальция.
Сегодня ацетилен в основном производится путем частичного сжигания метана или появляется как побочный продукт в потоке этилена при крекинге углеводородов. Таким образом ежегодно производится около 400 000 тонн (см. Приготовление ацетилена).
В Китае ацетилен, полученный из карбида кальция, остается сырьем для химическая индустрия, в частности для производства поливинил хлорид. Ацетилен местного производства более экономичен, чем использование импортного масла.[14] Производство карбида кальция в Китае увеличивается. В 2005 году добыча составила 8,94 миллиона тонн при мощности производства 17 миллионов тонн.[15]
В США, Европе и Японии потребление карбида кальция в целом снижается.[16] Уровень производства в США в 1990-е годы составлял 236 000 тонн в год.[13]
Производство цианамида кальция
Карбид кальция реагирует с азотом при высокой температуре с образованием цианамид кальция:[5]
CaC2 + N2 → CaCN2 + C
Обычно известный как нитролим, цианамид кальция используется в качестве удобрения. Гидролизуется до цианамид, H2NCN.[5]
Сталеплавильное производство
Карбид кальция используется:
- в обессеривание железа (чугун, чугун и сталь)[7]
- в качестве топлива в сталеплавильном производстве для увеличения доли брака в жидком чугуне в зависимости от экономических соображений.
- как мощный раскислитель в ковш очистные сооружения.
Карбидные лампы
Основная статья: Карбидная лампа
Горит карбидная лампа
Карбид кальция используется в карбидные лампы. При попадании капель воды на карбид образуется газ ацетилен, который горит и дает свет. Хотя эти лампы давали более ровный и яркий свет, чем свечи, они были опасны в каменный уголь шахты, где легковоспламеняющиеся метан газ сделал их серьезной опасностью. Наличие горючих газов на угольных шахтах привело к шахтерской лампы безопасности такой как Лампа Дэви, в котором проволочная сетка снижает риск воспламенения метана. Карбидные лампы по-прежнему широко использовались в шифер, медь, и банка шахты, где метан не представляет серьезной опасности. Большинство шахтерских ламп заменено на электрические. лампы.
Карбидные лампы все еще используются в горнодобывающей промышленности в некоторых менее богатых странах, например, в серебро шахты рядом Потоси, Боливия. Карбидные лампы все еще используются некоторыми спелеологи исследуя пещеры и другие подземные области,[17] хотя они все чаще заменяются в этом использовании ВЕЛ огни.
Карбидные лампы также широко использовались в качестве Фары в ранних автомобилях, мотоциклах и велосипедах, но были полностью заменены электрическими лампами.[18]
Другое использование
Карбид кальция иногда используется как источник газообразного ацетилена, который является агент созревания похожий на этилен.[19] Однако в некоторых странах это незаконно, поскольку при производстве ацетилена из карбида кальция загрязнение часто приводит к образованию следов фосфин и арсин.[20][21] Эти примеси можно удалить, пропустив ацетиленовый газ через подкисленный сульфат меди решение, но в развивающихся странах этой мерой предосторожности часто пренебрегают.
Карбид кальция используется в игрушечных пушках, таких как Пушка Большого Взрыва, а также в бамбуковые пушки. В Нидерландах карбид кальция используется ближе к новому году для стрельбы из маслобойки.[22]
Карбид кальция вместе с фосфид кальция, используется в плавучих самовоспламеняющихся морских сигнальные ракеты, например, производимые Ассоциация защиты морской жизни Холмса.
Карбид кальция используется для определения влажности почвы. Когда почва и карбид кальция смешиваются в закрытом цилиндре под давлением, вода, содержащаяся в почве, реагирует с карбидом кальция с выделением ацетилена, давление которого можно измерить для определения содержания влаги.[23][24]
Область применения
Карбид кальция (Calcium carbide) используется для получения цианамида кальция (методом реакции с азотом), из которого синтезируют цианистые соединения и удобрения, производства карбидно-карбамидных регуляторов роста растений и карбидного порошкового реагента.
Без этого вещества не обходится и проведение автогенных работ и освещения, изготовление ацетиленовой сажи и других материалов: синтетического каучука, алконитрила, стирола, винилхлорида, уксусной кислоты, хлорпроизводных ацетилена, искусственных смол, этилена, ацетона и др. Также оно применяется в процессе газосварки, производстве карбидных ламп.
Из специальной фракции calcium carbide (прошедшей переработку с применением отходов и некондиционного сырья) путем реакции с водой получают газ ацетилен и побочный продукт – гашеную известь. Эта процедура сопровождается выделением значительного количества тепла. Объем получаемого газа зависит от чистоты карбида кальция (чем чище материал, тем больше выйдет ацетилена) и варьируется в пределах 235-285 л от 1 кг карбида.
Теоретически для разложения 1 кг calcium carbide требуется 0,56 л воды, но на практике используют от 5 до 26 л жидкости, чтобы лучше охладить ацетилен и обеспечить безопасность процесса. Быстрота разложения будет зависеть от грануляции и чистоты исходного материала, а также от температуры и чистоты воды (чем чище и меньше размер, больше температура, тем выше скорость реакции).
Рекомендации
- Массалимов, И. А .; Киреева, М. С .; Сангалов, Ю. А. (2002). «Структура и свойства механоактивированного пероксида бария». Неорганические материалы
.
38
(4): 363. Дои:10.1023 / А: 1015105922260. S2CID 91881752. - Информация о рейтинге опасности NFPA для обычных химических веществ. Северо-Восточный университет
- Патнаик, Прадёт (2003). Справочник неорганических химических соединений
. Макгроу-Хилл. ISBN 0-07-049439-8 . - Винколи, Джеффри Уэйн (25 ноября 1996 г.). Управление рисками для опасных химических веществ
. CRC Press. п. 429. ISBN 978-1-56670-200-3 . - ^ абcd
Гринвуд, Норман Н.; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн. п. 298. ISBN 978-0-08-037941-8 . - Рассчитано на основе данных в CRC Справочник по химии и физике
. - ^ аб
Карбид кальция, Бернхард Лангхаммер, Энциклопедия промышленной химии Ульмана, Wiley Interscience. (Требуется подписка) - Фриман, Гораций (1919). «Производство цианамида». Химические новости и журнал физических наук
.
117
: 232. - Морхед, Дж. Т. и де Шалмот, Г. (1896). «Производство карбида кальция». Журнал Американского химического общества
.
18
(4): 311–331. Дои:10.1021 / ja02090a001.CS1 maint: несколько имен: список авторов (связь) - Муассан, Х. (1892). «Chimie Minérale — Description d’un nouveau four électrique». Comptes rendus hebdomadaires des séances de l’Académie des Sciences
.
115
: 1031. - Ренуф, Эдвард (1899). «Использование ацетилена». Ежемесячный научно-популярный журнал
: 335–347. - «Zgrada Prve hidrocentrale na Balkanu — Komisija za očuvanje nacionalnih spomenika». old.kons.gov.ba
(на сербохорватском). КОНС. Получено 15 марта 2022. - ^ аб
Гринвуд, Норман Н.; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8 . - Дун, Я (23.01.2006). «Неприятности в индустрии ПВХ». Совет по развитию торговли Гонконга. Архивировано 28 декабря 2007 года.CS1 maint: BOT: статус исходного URL-адреса неизвестен (связь)
- «Правительство принимает меры по сдерживанию развития карбида кальция». China Daily через BusyTrade.com. 2007-05-16. Архивировано 11 февраля 2007 года.CS1 maint: BOT: статус исходного URL-адреса неизвестен (связь)
- Лаксон, Джейми; Шлаг, Стефан; Токи, Горо (декабрь 2004 г.). «Карбид кальция». НИИ Консалтинг.
- «Спелеологическое снаряжение и культура (из энциклопедии Новой Зеландии Те Ара)».
- Клеммер, Грегг (1987). Карбидные лампы американских горняков: руководство для коллекционеров по освещению американских карбидных шахт
. Публикации Westernlore. - Абелес, Ф. Б. и Гахаган, Х. Э. III (1968). «Поглощение: роль этилена, аналогов этилена, двуокиси углерода и кислорода». Plant Physiol.43
(8): 1255–1258. Дои:10.1104 / стр.43.8.1255. ЧВК 1087003. PMID 16656908.CS1 maint: несколько имен: список авторов (связь) - «Ставка на это. Ваше манго созревает с использованием карбида». ДНК
. 2013-05-18. Получено 2018-08-25. - «Употребление в пищу искусственно созревших фруктов вредно».
- «Carbidschieten wordt feest» (на голландском). Алгемин Дагблад. 2016-12-24.
- Сингх, Рандхир. «Определение содержания воды в почве — метод карбида кальция». Портал гражданского строительства
. Получено 7 сентября 2022. - ASTM International. «ASTM D4944-18, Стандартный метод испытаний для определения содержания воды (влаги) в почве в полевых условиях с помощью измерителя давления газа карбида кальция». ASTM International. Получено 7 сентября 2022.
Ссылки [ править ]
- https://materialsproject.org/materials/mp-1575/
- Массалимов, ИА; Киреева, М.С.; Сангалов, Ю. А. (2002). «Структура и свойства механоактивированного пероксида бария». Неорганические материалы
.
38
(4): 363. DOI : 10,1023 / A: 1015105922260 . S2CID 91881752 . - Информация о рейтинге опасности NFPA для обычных химических веществ . Северо-Восточный университет
- Patnaik, Pradyot (2003). Справочник неорганических химических соединений
. Макгроу-Хилл. ISBN 0-07-049439-8 . - Винколи, Джеффри Уэйн (25 ноября 1996 г.). Управление рисками для опасных химических веществ
. CRC Press. п. 429. ISBN. 978-1-56670-200-3 . - ^ абвг
Гринвуд, Норман Н .; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн . п. 298. ISBN 978-0-08-037941-8 . - Рассчитано на основе данных CRC Handbook of Chemistry and Physics
. - ^ ab
Карбид кальция , Бернхард Лангхаммер, Энциклопедия промышленной химии Ульмана, Wiley Interscience. (Требуется подписка) - Фриман, Гораций (1919). «Производство цианамида» . Химические новости и журнал физических наук
.
117
: 232. - Морхед, JT и де Chalmot, G. (1896). «Производство карбида кальция» . Журнал Американского химического общества
.
18
(4): 311–331. DOI : 10.1021 / ja02090a001 .CS1 maint: multiple names: authors list (link) - Муассан, Х. (1892). «Chimie Minérale — Description d’un nouveau four électrique» . Comptes rendus hebdomadaires des séances de l’Académie des Sciences
.
115
: 1031. - Ренуф, Эдвард (1899). «Использование ацетилена» . Ежемесячный научно-популярный журнал
: 335–347. - «Zgrada Prve hidrocentrale na Balkanu — Komisija za očuvanje nacionalnih spomenika» . old.kons.gov.ba
(на сербохорватском). КОНС . Проверено 15 марта 2022 . - ^ ab
Гринвуд, Норман Н .; Эрншоу, Алан (1997).
Химия элементов
(2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 . - Дун, Я (23 января 2006 г.). «Неприятности в индустрии ПВХ» . Совет по развитию торговли Гонконга. Архивировано 28 декабря 2007 года.CS1 maint: bot: original URL status unknown (link)
- «Правительство принимает меры по сдерживанию развития сектора карбида кальция» . China Daily через BusyTrade.com. 2007-05-16. Архивировано 11 февраля 2007 года.CS1 maint: bot: original URL status unknown (link)
- Лаксон, Джейми; Шлаг, Стефан; Токи, Горо (декабрь 2004 г.). «Карбид кальция» . НИИ Консалтинг.
- «Спелеологическое оборудование и культура (из Энциклопедии Те Ара Новой Зеландии)» .
- Клеммер, Грегг (1987). Карбидные лампы американских горняков: Руководство для коллекционеров по освещению американских карбидных рудников
. Публикации Westernlore. - Абелес, FB и Gahagan, HE III (1968). «Поглощение: роль этилена, аналогов этилена, двуокиси углерода и кислорода» . Plant Physiol.43
(8): 1255–1258. DOI : 10.1104 / pp.43.8.1255 . PMC 1087003 . PMID 16656908 . CS1 maint: multiple names: authors list (link) - «Ставка на это. Ваше манго созревает с использованием карбида» . ДНК
. 2013-05-18 . Проверено 25 августа 2022 . - «Употребление искусственно созревших фруктов вредно» .
- «Carbidschieten wordt feest» (на голландском). Algemeen Dagblad . 2016-12-24.
- Сингх, Рандхир. «Определение содержания воды в почве — метод карбида кальция» . Портал гражданского строительства
. Проверено 7 сентября 2022 . - ASTM International. «ASTM D4944-18, Стандартный метод испытаний для определения содержания воды (влаги) в почве в полевых условиях с помощью измерителя давления газа карбида кальция» . ASTM International . Проверено 7 сентября 2022 .
- дю Буа, TME «Molehill Mayhem» . п. 21.
- «Как избавиться от дворовых кротов с помощью карбида» . mysunnylawn.com
.