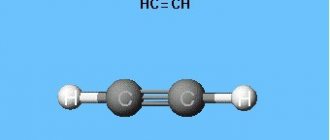
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Применение
Элементы используют, чтобы придать чугуну и разного вида сталям твердость, повысить их износоустойчивость. Карбиды вольфрама и титана, как наиболее твердые и тугоплавкие варианты, применяют для изготовление режущих инструментов, а также для получения сверхтвердых материалов. Благодаря хорошим химическим и физическим свойствам, вещества используют в качестве компонента огнеупорных материалов, стержней сопротивления электронагревательных приборов и в качестве абразивного материала.
Карбид кальция также называют карбидом для сварки. Это идеальное вещество для сварочных работ: при контакте с водой оно выделяет ацетилен — летучий газ, являющийся основой кислородной сварки, металлизации, резки и напайки.
Иначе говоря, при обработке металла соединение вступает в реакцию и начинает выделять огромное количество тепла и ацетилена, который поддерживает горение. Температура при этом может достигать 3150 градусов Цельсия. При работе с веществом необходимо строго придерживаться правил безопасности: правильно хранить смесь, помнить о том, что он легко загорается, стараться не контактировать с ядовитой полью.
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Карбиды
Водородные соединения углерода
Химические свойства углерода.
В обычных условиях углерод (особенно алмаз) очень инертен и вступает во взаимодействие только с очень энергичными окислителями. При нагревании химическая активность углерода повышается. В аморфном виде уголь и кокс легко горят на воздухе, образуя углекислый газ CO2. При недостатке кислорода углерод окисляется только до СО. Алмаз способен гореть лишь в чистом кислороде при 700 — 800ºС. Эта способность углерода окисляться при нагревании используется при восстановлении многих металлов из их оксидов.
C + 2F2 = CF4; C + O2 = CO2; 2C + O2 = 2CO;
C другими галогенами углерод непосредственно не соединяется, а соответствующие соединения получают косвенным путем. Четыреххлористый углерод получают пропусканием хлора через сероуглерод при 60ºС в присутствии катализатора FeS: CS2 + 2Cl2 = CCl4 + 2S.
При высокой температуре углерод взаимодействует с серой, азотом и кремнием:
C + 2S = CS2; 2C + N2 = C2N2 или (СN)2; C + Si = SiC (2000ºС).
С металлами углерод реагирует при высоких температурах, образуя карбиды. Карбиды также можно получить при взаимодействии угля с оксидами металлов:
3C + CaO = CaC2 + CO.
Углерод взаимодействует, как восстановитель, и с оксидами других металлов при нагревании: C + 2PbO = 2Pb + CO2.
Углерод растворяется только в кислотах-окислителях при нагревании:
С + 2H2SO4 (конц.) = CO2↑+ 2SO2↑+ 2H2O;
C + 4HNO3 (конц.) = CO2↑ + 4NO2↑ + 2H2O.
Углеводороды являются достаточно стабильными, так как перекрывание малых по размеру валентных орбиталей велико, различие в электроотрицательностях углерода и водорода мало, поэтому образуются прочные ковалентные связи С−Н.
Прямой синтез метана (простейшего углеводорода) можно осуществить только в присутствии катализатора, например мелкодисперсного никеля. Разнообразие углеводородных соединений объясняется способностью углерода к образованию бесконечных линейных и разветвленных цепочек (−С−С−, >С=С< и −C≡C−) замыканию их в циклы с одинарными или кратными связями между атомами углерода как в гомоатомных, так и в гетероатомных соединениях (ароматические соединения с делокализованными π-связями).
Сам метан не реагирует с водой, кислотами и щелочами, с кислородом взаимодействует только при поджигании. Ненасыщенные углеводороды являются более реакционноспособными, чем углеводороды ряда метана. Их примеси могут служить причиной самовоспламенения болотного газа (метана) в природных условиях.
С менее электроотрицательными элементами углерод образует соединения, которые называют карбидами. Их можно разделить на 3 группы.
Ионно-ковалентные карбиды (солеподобные) –к ним относят метаниды и ацетилениды. Метаниды
можно рассматривать как производные метана, содержащие ион С−4 , например карбид бериллия Be2C или карбид алюминия Al4C3. Это тугоплавкие кристаллические вещества, которые реагируют с разбавленными кислотами с выделением метана:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑.
Ацетилениды
— производные ацетилена состава М+12С2, М+2С2 и М+32(С2)3, содержат ион С2−2 (где М – это s- и d-металлыI и II группы периодической системы или Al+3). Ацетилениды детонируют даже в сухом виде, разлагаются водой и разбавленными кислотами:
CaC2 + 2H2O = Ca(OH)2 + C2H2.
Солеподобные карбиды получают при взаимодействии оксидов металлов с графитом при высокой температуре:
CaO + 3C = CaC2 + CO↑; 2 Al2O3 +9C = Al4C3 + 6CO.
Ацетилениды можно получить обменным взаимодействием ацетилена с солью соответствующего металла.
Металлоподобные карбиды – это карбиды d-металлов IV – VIII групп нестехиометрического состава, который изменяется в широких пределах; проявляют металлические свойства: металлический блеск, высокую твердость, высокие температуры плавления. Карбиды титана, ванадия, ниобия, молибдена и вольфрама характеризуются еще и высокой коррозионной устойчивостью.
Металлоподобные карбиды получают непосредственным взаимодействием металлов или их оксидов с углеродом в электропечах при высокой температуре:
3Fe + C = Fe3C; V2O5 + 7C = 2VC + 5CO.
Карбиды состава M3C (где металл имеет небольшой радиус) термически и химически менее устойчивы, например, разлагаются разбавленными кислотами, выделяя смесь углеводородов с достаточно длинными цепями.

Ковалентные карбиды с атомной кристаллической решеткой – B4C и SiC – продукты частичного замещения атомов углерода в структуре алмаза на атомы бора или кремния. Карбид бора очень тверд, царапает алмаз, химически достаточно инертен. Карборунд по твердости близок к алмазу, но более хрупок, химически стоек и окисляется кислородом только при температуре свыше 1000ºС. При сплавлении со щелочью в присутствии кислорода карборунд разрушается с образованием карбоната и силиката. SiC растворяется только в смеси концентрированных плавиковой и азотной кислот, в царской водке.
Такие карбиды получают в электропечах при очень высокой температуре из смесей соответственно SiO2 или B2O3 с коксом, графитом или сажей.
Применение. Металлические карбиды придают сталям и чугунам твердость, износоустойчивость. Карбиды вольфрама и тантала используют для изготовления режущих инструментов и получения сверхтвердых сплавов. Карборунд используют как абразивный материал, как компонент огнеупорных материалов, в качестве стержней сопротивления в электронагревательных приборах.
Водородные соединения углерода
Химические свойства углерода.
В обычных условиях углерод (особенно алмаз) очень инертен и вступает во взаимодействие только с очень энергичными окислителями. При нагревании химическая активность углерода повышается. В аморфном виде уголь и кокс легко горят на воздухе, образуя углекислый газ CO2. При недостатке кислорода углерод окисляется только до СО. Алмаз способен гореть лишь в чистом кислороде при 700 — 800ºС. Эта способность углерода окисляться при нагревании используется при восстановлении многих металлов из их оксидов.
C + 2F2 = CF4; C + O2 = CO2; 2C + O2 = 2CO;
C другими галогенами углерод непосредственно не соединяется, а соответствующие соединения получают косвенным путем. Четыреххлористый углерод получают пропусканием хлора через сероуглерод при 60ºС в присутствии катализатора FeS: CS2 + 2Cl2 = CCl4 + 2S.
При высокой температуре углерод взаимодействует с серой, азотом и кремнием:
C + 2S = CS2; 2C + N2 = C2N2 или (СN)2; C + Si = SiC (2000ºС).
С металлами углерод реагирует при высоких температурах, образуя карбиды. Карбиды также можно получить при взаимодействии угля с оксидами металлов:
3C + CaO = CaC2 + CO.
Углерод взаимодействует, как восстановитель, и с оксидами других металлов при нагревании: C + 2PbO = 2Pb + CO2.
Углерод растворяется только в кислотах-окислителях при нагревании:
С + 2H2SO4 (конц.) = CO2↑+ 2SO2↑+ 2H2O;
C + 4HNO3 (конц.) = CO2↑ + 4NO2↑ + 2H2O.
Углеводороды являются достаточно стабильными, так как перекрывание малых по размеру валентных орбиталей велико, различие в электроотрицательностях углерода и водорода мало, поэтому образуются прочные ковалентные связи С−Н.
Прямой синтез метана (простейшего углеводорода) можно осуществить только в присутствии катализатора, например мелкодисперсного никеля. Разнообразие углеводородных соединений объясняется способностью углерода к образованию бесконечных линейных и разветвленных цепочек (−С−С−, >С=С< и −C≡C−) замыканию их в циклы с одинарными или кратными связями между атомами углерода как в гомоатомных, так и в гетероатомных соединениях (ароматические соединения с делокализованными π-связями).
Сам метан не реагирует с водой, кислотами и щелочами, с кислородом взаимодействует только при поджигании. Ненасыщенные углеводороды являются более реакционноспособными, чем углеводороды ряда метана. Их примеси могут служить причиной самовоспламенения болотного газа (метана) в природных условиях.
С менее электроотрицательными элементами углерод образует соединения, которые называют карбидами. Их можно разделить на 3 группы.
Ионно-ковалентные карбиды (солеподобные) –к ним относят метаниды и ацетилениды. Метаниды
можно рассматривать как производные метана, содержащие ион С−4 , например карбид бериллия Be2C или карбид алюминия Al4C3. Это тугоплавкие кристаллические вещества, которые реагируют с разбавленными кислотами с выделением метана:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑.
Ацетилениды
— производные ацетилена состава М+12С2, М+2С2 и М+32(С2)3, содержат ион С2−2 (где М – это s- и d-металлыI и II группы периодической системы или Al+3). Ацетилениды детонируют даже в сухом виде, разлагаются водой и разбавленными кислотами:
CaC2 + 2H2O = Ca(OH)2 + C2H2.
Солеподобные карбиды получают при взаимодействии оксидов металлов с графитом при высокой температуре:
CaO + 3C = CaC2 + CO↑; 2 Al2O3 +9C = Al4C3 + 6CO.
Ацетилениды можно получить обменным взаимодействием ацетилена с солью соответствующего металла.
Металлоподобные карбиды – это карбиды d-металлов IV – VIII групп нестехиометрического состава, который изменяется в широких пределах; проявляют металлические свойства: металлический блеск, высокую твердость, высокие температуры плавления. Карбиды титана, ванадия, ниобия, молибдена и вольфрама характеризуются еще и высокой коррозионной устойчивостью.
Металлоподобные карбиды получают непосредственным взаимодействием металлов или их оксидов с углеродом в электропечах при высокой температуре:
3Fe + C = Fe3C; V2O5 + 7C = 2VC + 5CO.
Карбиды состава M3C (где металл имеет небольшой радиус) термически и химически менее устойчивы, например, разлагаются разбавленными кислотами, выделяя смесь углеводородов с достаточно длинными цепями.
Ковалентные карбиды с атомной кристаллической решеткой – B4C и SiC – продукты частичного замещения атомов углерода в структуре алмаза на атомы бора или кремния. Карбид бора очень тверд, царапает алмаз, химически достаточно инертен. Карборунд по твердости близок к алмазу, но более хрупок, химически стоек и окисляется кислородом только при температуре свыше 1000ºС. При сплавлении со щелочью в присутствии кислорода карборунд разрушается с образованием карбоната и силиката. SiC растворяется только в смеси концентрированных плавиковой и азотной кислот, в царской водке.
Такие карбиды получают в электропечах при очень высокой температуре из смесей соответственно SiO2 или B2O3 с коксом, графитом или сажей.
Применение. Металлические карбиды придают сталям и чугунам твердость, износоустойчивость. Карбиды вольфрама и тантала используют для изготовления режущих инструментов и получения сверхтвердых сплавов. Карборунд используют как абразивный материал, как компонент огнеупорных материалов, в качестве стержней сопротивления в электронагревательных приборах.
Как это может быть полезно в жизни?
Ну, во-первых, знание химических соединений никогда не может быть лишним. Всегда лучше быть вооружённым знанием, чем остаться без него. Во-вторых, чем больше вы знаете о существовании определённых соединений, тем лучше понимаете механизм их образования и законы, которые позволяют им существовать.
Перед тем как перейти к окончанию, хотелось бы дать несколько рекомендаций по изучению этого материала.